



RESOLUCION 2108 DE 2019
(Noviembre 12)
Gaceta Oficial No. 2457 de 2 de marzo de 2019
SECRETARÍA GENERAL DE LA COMUNIDAD ANDINA
Reglamento de la Decisión 833 "Armonización de Legislaciones en materia de Productos Cosméticos"
LA SECRETARIA GENERAL DE LA COMUNIDAD ANDINA,
VISTOS: El artículo 30 literal b) del Acuerdo de Cartagena, la Primera Disposición Final de la Decisión 833 sobre Armonización de Legislaciones en Materia de Productos Cosméticos y las Resoluciones No 1333, 1418, 1482, 1906 y 1954;
CONSIDERANDO: Que, la Primera Disposición Final de la Decisión 833 sobre Armonización de Legislaciones en Materia de Productos Cosméticos establece que la Secretaría General, con recomendación de las Autoridades Nacionales Competentes de los Países Miembros, adoptará mediante Resolución las disposiciones que reglamenten la correcta aplicación de la citada Decisión;
Que, la Resolución No 1333 establece los criterios de homologación de la codificación en materia de cosméticos y los formatos para la Notificación Sanitaria Obligatoria (NSO) de productos cosméticos, su renovación, reconocimiento y cambios;
Que, la Resolución No 1418 y su modificatoria, la Resolución No 1482, establecen los límites de contenido microbiológico de los productos cosméticos;
Que, la Resolución No 1906 establece la lista armonizada de formas cosméticas;
Que, la Resolución No 1954 establece el procedimiento para el pronunciamiento por parte de las Autoridades Sanitarias y la Secretaría General respecto a la solicitud de un País Miembro para incluir una nueva forma cosmética;
Que, el Grupo de Expertos Gubernamentales para la Armonización de Legislaciones Sanitarias (Sanidad Humana), en su reunión realizada del 29 de octubre de 2019, en conformidad con la Disposición Final Primera de la Decisión 833, recomendó a la Secretaría General de la Comunidad Andina la adopción mediante Resolución del Reglamento de la citada Decisión.
RESUELVE:
Aprobar el siguiente Reglamento de la Decisión 833 sobre Armonización de Legislaciones en Materia de Productos Cosméticos.
DE LAS CONDICIONES GENERALES.
ARTÍCULO 1. La Autoridad Nacional Competente de cada País Miembro, como parte de su acción de control y vigilancia de los productos cosméticos fabricados o comercializados en la subregión, verificará el cumplimiento de lo establecido en la Decisión 833.
ARTÍCULO 2. La Notificación Sanitaria Obligatoria (NSO) sólo tendrá un único titular conforme con lo establecido en el artículo 7 de la Decisión 833.
ARTÍCULO 3. Para efectos del presente Reglamento se aplicarán las siguientes definiciones, además de las establecidas en la Decisión 833:
3.1 Importador paralelo: persona natural o jurídica que se acoge a la NSO existente de un producto cosmético para su importación y comercialización en la subregión andina, quien debe tener domicilio legal en el País Miembro de comercialización (artículo 11 de la Decisión 833).
3.2 Kit comercial / promocional: agrupación de productos cosméticos en una unidad de venta, disponibles para su comercialización; los productos que lo conforman deben contar con código de NSO de manera individual.
El kit comercial / promociona! no corresponde a una presentación comercial y no requiere notificarse ni comunicarse a la Autoridad Nacional Competente.
3.3 Presentación comercial: corresponde al tipo de envase primario y/o secundario y contenido neto del producto terminado.
DE LA NOTIFICACION SANITARIA OBLIGATORIA.
ARTÍCULO 4. Los trámites de asignación del código de Notificación Sanitaria Obligatoria (NSO), solicitudes de reconocimiento, renovación, modificaciones de la información y para acogerse a un código de NSO existente, se realizarán mediante el instructivo y el formato de aplicación establecidos en los Anexos 1 y IV Parte A de la presente Resolución.
En los trámites de renovación no se podrán realizar solicitudes de modificación de la información sobre la NSO otorgada.
ARTÍCULO 5. El importador paralelo informará a la Autoridad Nacional Competente su decisión de no continuar acogiéndose al código de la NSO autorizado.
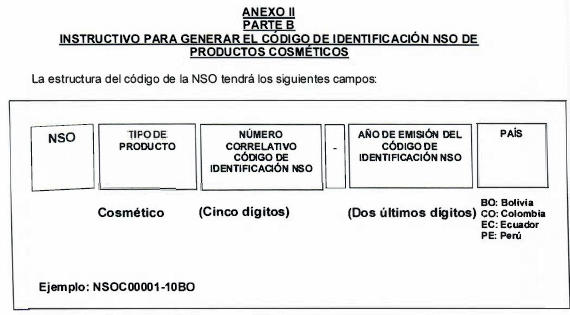
ARTÍCULO 6. Las Autoridades Nacionales Competentes emitirán respuesta a los interesados sobre el código de identificación de la NSO, asignado o renovado o sobre el que se solicitó acogerse, mediante el formato y la estructura armonizada de dicho código, establecidos en el Anexo 11 y el Anexo IV Parte B de la presente Resolución.
ARTÍCULO 7. Para fines del reconocimiento de la NSO, las Autoridades Nacionales Competentes emitirán respuesta a los interesados utilizando el formato establecido en el Anexo 111 de la presente Resolución.
ARTÍCULO 8. Para las especificaciones microbiológicas requeridas, según lo establecido en el literal 1) del artículo 9 de la Decisión 833, los productos cosméticos que se comercialicen en la subregión deben cumplir con el Reglamento Técnico Andino que apruebe la Secretaría General de la Comunidad Andina mediante Resolución.
DE LAS FORMAS COSMÉTICAS.
ARTÍCULO 9. En virtud de lo establecido en el literal f) del artículo 9 y la lista indicativa del Anexo 1 de la Decisión 833, sus ampliatorias o modificatorias, los productos cosméticos deben ser clasificados de acuerdo al siguiente listado de formas cosméticas:
1.ACEITE: Sustancia inmiscible con agua; grasosa, viscosa y líquida a temperatura ambiente.
2. AEROSOL: Forma presurizada que contiene ingredientes que se liberan bajo la activación del sistema válvula para dispersar líquidos, sólidos o gases.
3. BARRA: Mezcla sólida que se aplica por deslizamiento.
4. SÓLIDO COMPACTO: Mezcla sólida que requiere estar disuelta para su aplicación.
5. CERA: Mezcla de naturaleza grasa; natural o sintética; sólida o semisólida.
6. EMULSIÓN: Sistema heterogéneo de dos o más fases, de consistencia semisólida o fluida, estabilizado con un emulsificante.
7. CREMA GEL: Sistema coloidal donde la fase continua es sólida y la dispersa es líquida a la que se le agrega pequeñas cantidades de grasa y están en el límite de las emulsiones.
8. ESMALTE: Mezcla a base de solventes que, al ser aplicada sobre una superficie seca, forma una película de cubierta.
9. GEL: Sistema coloidal, donde la fase continua es sólida y la dispersa es líquida.
10. GRANULADO: Pequeñas partículas que usualmente se disuelven o se dispersan en medios acuosos o heterogéneos.
11. LÁPIZ: Pasta sólida compactada dentro de un cilindro que imita la forma de un lápiz común, que se aplica en la piel.
12. LOCIÓN: Mezcla o combinación de dos o más fases de consistencia fluida que tienen como componente mayoritario el agua, pudiendo también contener alcohol y glicoles, que contiene el soluto disperso o diluido.
13. SOPORTE IMPREGNADO: Base que hace de soporte en la cual se impregna la mezcla o sustancia cosmética.
14. PASTA: Forma semisólida con un alto contenido de sólidos finamente dispersos, con una consistencia firme.
15. PERLAS: Envases blandos de gelatina o polímeros que contienen en su interior soluciones oleosas o acuosas.
16. POLVO: Mezcla de sólidos sueltos o compactados, finamente divididos. Mezcla de partículas sólidas finamente divididas, sueltas o compactadas.
17. POMADA: Sustancia de naturaleza grasa para la aplicación en la piel. La diferencia fundamental con las emulsiones es la ausencia de agua.
18. SOLUCIÓN: Mezcla de uno o varios solutos en uno o varios disolventes.
19. SUSPENSIÓN: Sistema disperso constituido por una fase sólida insoluble en una fase líquida o semilíquida.
ARTÍCULO 10. Para la aplicación del artículo anterior, se entenderá como "Forma Cosmética" a la presentación final del producto cosmético con determinadas características físico- químicas para su adecuada presentación y uso.
ARTÍCULO 11. Cuando la Autoridad Nacional Competente emita la Autorización Sanitaria de Funcionamiento o Certificado de Capacidad o Permiso de Funcionamiento para los establecimientos en cumplimiento de tas Buenas Prácticas de Manufactura, ésta debe incluir las formas cosméticas contempladas en la presente Resolución, clasificadas según las áreas de fabricación.
Las modificaciones o ampliaciones por formas cosméticas que se realicen con posterioridad al otorgamiento de la Autorización Sanitaria de Funcionamiento o Certificado de Capacidad o Permiso de Funcionamiento, deben ser solicitados por el interesado a la ANC.
ARTÍCULO 12. Los productos cosméticos de la lista indicativa del Anexo 1 de la Decisión 833, sus ampliatorias o modificatorias, serán clasificados de acuerdo al listado de formas cosméticas previsto en el artículo 9 de la presente Resolución.
ARTÍCULO 13. La Secretaria General, previa consulta a los Países Miembros y mediante Resolución, podrá incluir una nueva forma cosmética a los productos cosméticos de la lista indicativa del Anexo 1 de la Decisión 833, si así lo requiere el desarrollo tecnológico de la industria cosmética.
Para tal efecto, se deberá observar el siguiente procedimiento:
1. El interesado (solicitante), en el caso de requerir la inclusión de una forma cosmética diferente a las establecidas en la presente Resolución, deberá presentar la respectiva solicitud a la Autoridad Nacional Competente del primer País Miembro de comercialización del producto, con los soportes técnicos y científicos que justifiquen la necesidad de inclusión de la nueva forma cosmética.
La información que sustente la solicitud de la nueva forma cosmética debe contener como mínimo:
a) La descripción completa del proceso de fabricación (incluido el proceso de envase);
b) Las características fisicoquímicas de la nueva forma cosmética en la presentación final del producto; y,
c) Los requerimientos técnicos del envase del producto (incluido las características fisicoquímicas del material de envase y sus accesorios).
2. La Autoridad Nacional Competente tendrá hasta 45 días hábiles para analizar, requerir información complementaria y emitir opinión a través de un informe técnico, mediante el siguiente procedimiento:
a) Recepcionada la solicitud, la Autoridad Nacional Competente tendrá un plazo de 15 días hábiles contados a partir del día siguiente de presentada la solicitud para analizarla y, en caso de requerir información complementaria, la solicitará al interesado, quien dispondrá de 15 días hábiles contados a partir del día siguiente de su notificación para presentar la información requerida. De no remitir la misma, se entenderá desistida la solicitud.
Recepcionada la información completa, la Autoridad Nacional Competente emitirá su opinión mediante un informe técnico dentro de un plazo máximo de 15 días hábiles contados a partir del día siguiente de recibida la misma estableciendo sí procede o no la presentación de la solicitud de inclusión de la nueva forma cosmética ante el Grupo de Expertos Gubernamentales para la Armonización de Legislaciones Sanitarias (Sanidad Humana).
3. La Autoridad Nacional Competente solicitará a la Secretaría General que convoque a una reunión del Grupo de Expertos para revisión de la solicitud, suministrando la información remitida por el interesado y el Informe Técnico de la Autoridad Nacional Competente del País Miembro que recibió la misma, de tal forma que, a la fecha de la reunión, cada País Miembro exponga su opinión y por consenso se recomiende la inclusión o no de la forma cosmética.
4. Si de la evaluación de los motivos y razones técnicas realizada por el mencionado Grupo de Expertos, resulta que no corresponde la inclusión de una nueva forma cosmética, se emitirá un Informe Técnico motivado con dicha recomendación. Este documento servirá de soporte para que la respectiva Autoridad Nacional Competente comunique la respuesta al solicitante.
Si la motivación técnica justifica la inclusión de la nueva forma cosmética, el Grupo de Expertos emitirá un Informe Técnico motivado con dicha recomendación. La Secretaría General en un plazo no mayor a tres (03) meses contados a partir del día siguiente de recibido el Informe Técnico motivado, emitirá la Resolución correspondiente.
ARTÍCULO 14. Una vez presentada la solicitud bajo el artículo 13 y el interesado requiere iniciar el trámite de la NSO, deberá consignar provisionalmente la forma cosmética que tenga las características físico-químicas más similares a la presentación y uso del producto cosmético establecidas en la lista de formas cosméticas armonizadas; hasta que se resuelva la inclusión de la nueva forma cosmética, según lo establecido en el artículo anterior de la presente Resolución.
ARTÍCULO 15. Aprobada la inclusión de la nueva forma cosmética bajo el procedimiento del artículo 13, la Autoridad Nacional Competente que recibió la solicitud, comunicará al interesado la nueva asignación de la forma cosmética de su producto, quien actualizará esta modificación en la respectiva NSO. Esta modificación y su reconocimiento no tendrá costo para el interesado.
DISPOSICIONES FINALES.
Primera.- Deróguese las Resoluciones No 1333; 1418; 1482; 1906 y 1954 de la Secretaría General de la Comunidad Andina.
Segunda.- La legislación interna de los Países Miembros será de aplicación en todo lo que no se oponga al presente Reglamento.
Tercera.- El presente Reglamento será publicado en la Gaceta Oficial del Acuerdo de Cartagena y entrará en vigencia conjuntamente con la Decisión 833.
Dada en la ciudad de Lima, Perú, a los doce días del mes de noviembre del año dos mil diecinueve.
Jorge Hernando Pedraza
Secretario General














Las notas de vigencia, concordancias, notas del editor, forma de presentación y disposición de la compilación están protegidas por las normas sobre derecho de autor. En relación con estos valores jurídicos agregados, se encuentra prohibido por la normativa vigente su aprovechamiento en publicaciones similares y con fines comerciales, incluidas -pero no únicamente- la copia, adaptación, transformación, reproducción, utilización y divulgación masiva, así como todo otro uso prohibido expresamente por la normativa sobre derechos de autor, que sea contrario a la normativa sobre promoción de la competencia o que requiera autorización expresa y escrita de los autores y/o de los titulares de los derechos de autor. En caso de duda o solicitud de autorización puede comunicarse al teléfono 617-0729 en Bogotá, extensión 101. El ingreso a la página supone la aceptación sobre las normas de uso de la información aquí contenida.