



CIRCULAR 15 DE 2023
(julio 28)
Diario Oficial No. 52.470 de 28 de julio de 2023
MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL
COMISIÓN NACIONAL DE PRECIOS DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS
Por la cual se establecen disposiciones generales para el seguimiento del comportamiento del mercado de dispositivos médicos, se someten algunos de estos productos al régimen de libertad vigilada y el estent coronario medicado al régimen de control directo, se estructura el Sistema de Reporte de Información de Precios de Dispositivos Médicos.
LA COMISIÓN NACIONAL DE PRECIOS DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS,
en ejercicio de sus facultades legales, en especial de las conferidas por los artículos 245 de la Ley 100 de 1993, 87 de la Ley 1438 de 2011 y 3o del Decreto número 1071 de 2012, y
CONSIDERANDO:
Que el artículo 60 de la Ley 81 de 1988 dispone que el ejercicio de la política de precios de diversos productos, entre los que se encuentran los medicamentos y dispositivos médicos, podrá ejercerse por las autoridades competentes bajo las siguientes modalidades: i) Régimen de control directo; ii) Régimen de libertad regulada y iii) Régimen de libertad vigilada.
Que el artículo 245 de la Ley 100 de 1993 establece que el Ejecutivo reglamentará el régimen de registros y licencias, así como el régimen de vigilancia sanitaria y control de calidad de los productos de qué trata el objeto del Invima, entre ellos los medicamentos y dispositivos médicos.
Que la Ley 1438 de 2011 en el artículo 90 estableció que el Gobierno nacional garantizará la competencia efectiva para la producción, venta, comercialización y distribución de medicamentos y dispositivos médicos.
Que a su turno el Decreto número 1071 de 2012 en su artículo 3o, definió entre las funciones de la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos, la de fijar y adoptar los lineamientos generales para la formulación y regulación de la política de precios de medicamentos y dispositivos médicos.
Que el literal j) del artículo 5o de la Ley Estatutaria 1751 de 2015, dispone como una de las obligaciones del Estado la de intervenir el mercado de medicamentos, dispositivos médicos en salud con el fin de optimizar su utilización, evitar las inequidades en el acceso, asegurar la calidad de estos o en general cuando pueda derivarse una grave afectación de la prestación del servicio.
Que, en virtud de lo anterior, la Comisión tiene la función de fijar y adoptar los lineamientos generales para la formulación y regulación de la política de precios de medicamentos y dispositivos médicos, con base en criterios de (i) carácter técnico y económico que de acuerdo con su competencia, considere convenientes o necesarios el Ministerio de Comercio, Industria y Turismo, o (ii) de carácter técnico relacionados con el sector salud que de acuerdo con su competencia considere convenientes o necesarios el Ministerio de Salud y Protección Social, o (iii) estudios técnicos presentados a su consideración por la Secretaría Técnica de la Comisión.
Que, desde el año 2015 y hasta la fecha, la Comisión ha expedido diversos actos que regulan la materia de la siguiente manera: Circular número 01 de 2015, a través de la cual se interviene en los mercados de dispositivos médicos, se establece un régimen de libertad vigilada para los mismos y se someten unos estents coronarios a control directo, surtiendo modificaciones por medio de la Circular número 02 del mismo año; la Circular número 02 de 2016, a través de la cual se introducen ajustes por variación de precios a los estents coronarios y la Circular número 02 de 2017, modificada por la Circular número 05 de 2018, que incorpora al régimen de libertad vigilada los dispositivos médicos anticonceptivos, se sustituye el Anexo Técnico número 1, adoptado con la Circular número 01, y la Circular número 13 de 2021, que ajusta el precio de los estents coronarios.
Que, la Circular número 14 de 2022 estableció las disposiciones generales para el seguimiento del comportamiento del mercado de dispositivos médicos, incorporó al régimen de libertad vigilada los implantes auditivos de conducción ósea, los dispositivos médicos de implante para córnea, para implante coclear e implantables para terapia cardíaca de alto voltaje, manteniendo todos los dispositivos médicos incorporados con las circulares anteriores en dicho régimen y conservando el estent coronario medicado en el régimen de control directo. Adicionalmente, estructuró el Sistema de Reporte de Información de Precios de Dispositivos Médicos (SISDIS).
Que, previo a la implementación del referido Sistema de reporte de información y en las actividades de socialización de la precitada Circular número 14, se evidenció la necesidad de realizar ajustes en las especificaciones establecidas en el anexo técnico de esta circular para que el proceso de cargue de datos se facilitara, se pudiera evitar la duplicidad en la información y que el sistema se constituyera en la herramienta efectiva y útil para soportar y justificar la toma de decisiones sobre la formulación de los precios de dispositivos médicos en el país.
Que, de acuerdo a los ajustes técnicos requeridos para el sistema, de manera consecuente, es necesario modificar el alcance de los reportes de información de precios en la cadena de comercialización, para que se establezcan los puntos de control en las transacciones relevantes del mercado, especificando los actores que deben cumplir dicho reporte, el período en el cual debe hacerse, la clasificación de fechas de cargue ordinario o extemporáneo y la referenciación internacional que debe tenerse en cuenta para el cálculo del precio del estent coronario medicado. Para el caso de los implantes cocleares y de conducción ósea, se precisa e indica que el reporte debe realizarse cuando sean suministrados por primera vez al paciente.
Que, de conformidad con lo anterior, se considera necesario derogar la Circular número 14 de 2022 y recoger en este acto administrativo todas las condiciones técnicas y de carácter operativo requeridas para el seguimiento del comportamiento del mercado de dispositivos médicos, la implementación y puesta en marcha del sistema de reporte de información de precios de dispositivos.
Que los temas que se van a regular a través del presente acto no limitan el número o la variedad de las empresas en el mercado, ni la capacidad de estas para competir, razón por la cual no se hace necesario solicitar concepto de abogacía de la competencia ante la Superintendencia de Industria y Comercio.
Que el articulado completo del proyecto de circular fue sometido a consulta pública entre el 16 de febrero de 2023 y el 3 de marzo de 2023, recibiendo comentarios de la ciudadanía que se analizaron y constituyen el fundamento de algunas de las decisiones adoptadas en el presente acto administrativo.
En mérito de lo expuesto,
RESUELVE:
OBJETO Y DEFINICIONES.
ARTÍCULO 1o. OBJETO. La presente circular tiene por objeto establecer disposiciones generales para el seguimiento del comportamiento del mercado de dispositivos médicos, someter algunos de estos productos en el régimen de libertad vigilada y el estent coronario medicado al régimen de control directo y estructurar el Sistema de Reporte de Información de Precios de Dispositivos Médicos (SISDIS).
ARTÍCULO 2o. ÁMBITO DE APLICACIÓN. La presente circular aplica a los actores que participan en la cadena de comercialización de los dispositivos médicos objeto de regulación de precios, realizando transacciones primarias, secundarias o finales, incluyendo los titulares de registro sanitario y a los prestadores de servicios de salud en todos los regímenes incluyendo el Especial y de Excepción.
ARTÍCULO 3o. DEFINICIONES. Para efectos de la presente circular, además de las definiciones contenidas en el Decreto número 4725 de 2005 o aquel que lo sustituya, modifique o derogue, le serán aplicables las siguientes:
3.1. Anillo intracorneal: banda circular implantable y abierta en un extremo, para aplanar la curvatura anterior de la córnea sin afectar al eje visual, a fin de corregir la miopía leve o moderada. Se inserta en la córnea a través de un canal intraestromal creado con un bisturí de diamante o láser. Es de plástico y tiene un diámetro externo e interno de aproximadamente 8 y 6,8 mm, respectivamente.
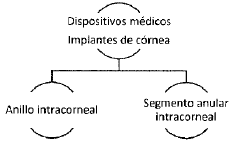
3.2. Anticonceptivos de barrera: dispositivo anticonceptivo en forma de vaina que crea una barrera física y es destinado a evitar la fecundación o a evitar la transmisión de enfermedades de transmisión sexual (ETS). Puede tener textura, sabor o contener lubricantes. Se trata de un dispositivo de un solo uso.
3.3. Anticonceptivos invasivos: dispositivo anticonceptivo diseñado para introducirse (se implanta sin cirugía) dentro de la cavidad uterina, cerca del fondo, y evitar la fecundación. Normalmente conocido como DIU, lo coloca un profesional sanitario cualificado usando dispositivos que habitualmente se incluyen (p. ej., un introductor). Se trata de un dispositivo de un solo uso.
3.4. Canal institucional: corresponde al canal donde se realizan las transacciones de compra, venta y recobro de dispositivos médicos con recursos públicos. Hacen parte del canal institucional los agentes que intervienen en la cadena de compra, venta y recobro de dispositivos médicos con recursos públicos, que incluye a los vendedores y compradores de regímenes Especial y de Excepción.
3.5. Canal comercial: corresponde al canal donde se realizan las transacciones de compra y venta de dispositivos médicos con recursos que no son públicos.
3.6. Conjunto de productos relevantes para la regulación de precios por su sustituibilidad terapéutica o funcional: corresponde al conjunto de dispositivos médicos para los que se reconoce sustituibilidad terapéutica y/o funcional, considerando la evidencia científica disponible o su uso. Estos pueden corresponder a más de un mercado relevante por existir evidencia de baja sustituibilidad económica entre subconjuntos de estos dispositivos médicos.
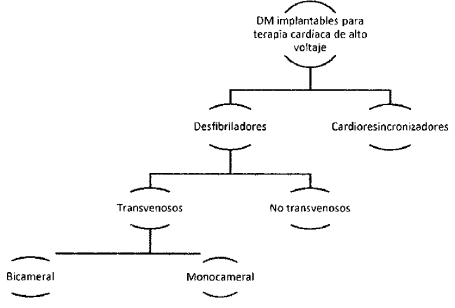
3.7. Dispositivos médicos implantables para terapia cardíaca de alto voltaje-desfibrilador transvenoso bicameral: generador de impulsos implantable, con un sistema de reconocimiento del ritmo cardíaco, que permite analizar un electrocardiograma y suministra un impulso eléctrico para desfibrilar el corazón (restablecer su ritmo normal) o disminuir la frecuencia cardíaca, así como para estimular el corazón en caso de bradicardia. Cuenta con derivaciones que se colocan dentro o sobre dos cavidades cardíacas homolaterales (aurícula y ventrículo) para monitorizar los parámetros electrocardiográficos y brindar de forma automática el impulso eléctrico. Incluye baterías internas que proporcionan la energía necesaria para suministrar los impulsos, y se conoce habitualmente como cardioversor-desfibrilador implantable automático.
3.8. Dispositivos médicos implantables para terapia cardíaca de alto voltaje-resincronizadores: dispositivo implantable estéril alimentado por baterías que consta de un generador de impulsos de electroestimulación cardíaca, cerrado herméticamente y un generador de impulsos de desfibrilación integrado con derivaciones colocadas en el ventrículo derecho, en una vena coronaria sobre el ventrículo izquierdo y, con frecuencia, en la aurícula derecha (tricameral). Además de las funciones de desfibrilación y marcapasos convencionales, el aparato suministra tratamiento de resincronización cardíaca mediante estimulación eléctrica biventricular, con el fin de sincronizar las contracciones de los ventrículos derecho e izquierdo, de forma que aumente la eficacia del bombeo sanguíneo, lo que permite tratar síntomas de insuficiencia cardíaca (p. ej., respiración entrecortada, fatiga rápida) y problemas graves relacionados con el ritmo cardíaco (desfibrilador TRSC).
3.9. Dispositivos médicos implantables para terapia cardíaca de alto voltaje-desfibrilador transvenoso monocameral: generador de impulsos implantable, con un sistema de reconocimiento del ritmo cardíaco, que permite analizar un electrocardiograma y suministra un impulso eléctrico para desfibrilar el corazón (restablecer su ritmo normal) o disminuir la frecuencia cardíaca. Cuenta con derivaciones que se colocan dentro o sobre una cavidad cardíaca (normalmente, un ventrículo) para monitorizar los parámetros electrocardiográficos y brindar de forma automática el impulso eléctrico que permite tratar la fibrilación ventricular o la taquicardia. Incluye baterías internas que proporcionan la energía necesaria para suministrar las descargas, y se conoce habitualmente como cardioversor-desfibrilador implantable automático.
3.10. Dispositivos médicos para implante coclear: conjunto de dispositivos (implante coclear [IC]) alimentado por baterías diseñado para la restauración parcial de la sensación auditiva en una persona con sordera profunda. Consta de una matriz electrodos interna que se implanta en la cóclea y se conecta a un estimulador receptor implantado cerca del oído, un procesador de sonido y micrófono colocado externamente, una unidad de batería, el cable de la bobina y la propia bobina (transmisor). El procesador de sonido (transductor) convierte las ondas sonoras en señales eléctricas y las envía a la bobina (transmisor) a través del cable correspondiente. La bobina transmite las señales al estimulador receptor y finalmente a la cóclea a través de la matriz de electrodos. Pueden estar incluidos el instrumental de implantación especializado.
3.11. Estent coronario convencional: dispositivo endovascular coronario implantable de forma permanente, cuyo fin es mejorar el espacio luminal del vaso sin liberar medicamento alguno.
3.12. Estent coronario medicado: dispositivo endovascular coronario implantable de forma permanente, cuyo fin es mejorar el espacio luminal del vaso liberando algún medicamento.
3.13. Implante auditivo de conducción ósea: dispositivo acústico externo, alimentado eléctricamente, destinado a compensar la discapacidad auditiva mediante la transmisión de vibraciones, desde ondas sonoras traducidas, a través del cráneo hasta el oído interno. Por lo general, incorpora un micrófono, amplificador y vibrador conectados a un imán externo que está acoplado magnéticamente a un imán que no vibra implantado en la cabeza para su retención; puede incluir dispositivos de posicionamiento y protección. El micrófono recibe ondas sonoras y las convierte en señales eléctricas enviadas al vibrador que transmite vibraciones a los oídos internos para escuchar. Este dispositivo se usa generalmente para tratar la discapacidad auditiva debido a patologías obstructivas del oído medio y/o externo. Comprende el audífono de conducción ósea: implante magnético y el sistema de implante de oído medio parcialmente implantable.
3.14. Mercado relevante: también denominado conjunto de productos relevantes, corresponde a un grupo de dispositivos médicos para los cuales existe evidencia científica sobre similitud en las características del producto y su sustituibilidad terapéutica y/o funcional, así como la información de precios de que no existen diferencias significativas asociadas a las características terapéuticas del producto o de su uso. Para la conformación de los mercados relevantes las diferencias en precios relacionadas con la marca comercial, fabricante, accesorios y servicios adicionales no serán un criterio relevante para el análisis de sustitución económica, ni de separación de mercados.
3.15 Reporte en cero: todo fabricante o importador de los dispositivos médicos incluidos en los regímenes de libertad vigilada, libertad regulada o control directo que tengan registro sanitario y no realicen ventas durante el período de reporte, deberá en todo caso realizar el reporte en ceros. Para actores diferentes al fabricante o importador no se requiere realizar el reporte en ceros.
3.16. Segmento anular intracorneal: arco implantable para aplanar la curvatura anterior corneal sin alterar el eje visual, con el fin de corregir determinados trastornos visuales relacionados con la córnea. Es un arco de plástico de unos 150 grados que se suministra por pares, se introduce en la córnea a través de un canal intraestromal realizado con un bisturí de diamantes o láser, y puede implantarse lejos de la incisión radial para reducir la posibilidad de que surjan complicaciones. El tamaño oscila entre 0,25 y 0,35 milímetros. Se utiliza para corregir la miopía leve o moderada y tratar a los pacientes que presentan astigmatismo irregular provocado por queratocono, especialmente aquellos que no pueden beneficiarse del uso de lentes de contacto o gafas.
3.17. Transacción primaria: corresponde a: i) la primera venta en Colombia del dispositivo médico objeto de reporte por parte de quien fabrica o importa a otro actor de la cadena o ii) a la primera compra en el territorio nacional colombiano del dispositivo médico objeto de reporte, realizada al actor que lo fabrica o lo importa.
3.18. Transacción secundaria: es aquella en la que se hace compra o venta por actores que no fabrican o importan el dispositivo médico. No comprende la dispensación o suministro final del dispositivo médico.
3.19. Transacción final: corresponde a la venta del dispositivo médico que haya sido dispensado o suministrado a un paciente por una Institución Prestadora de Salud (IPS) e igualmente, a la compra del dispositivo médico que vaya a ser dispensado o suministrado a un paciente por una Institución Prestadora de Salud (IPS). Se exceptúan del reporte aquellas operaciones de comodato, alquiler o arriendo de dispositivos médicos.
DISPOSICIONES GENERALES.
ARTÍCULO 4o. FUENTES DE INFORMACIÓN. La Comisión iniciará la inclusión gradual de los dispositivos médicos al régimen de libertad vigilada. Adicionalmente y durante la implementación de este régimen, así como para la aplicación del régimen de control directo o de libertad regulada, utilizará las fuentes de información disponibles. La Comisión preferirá el uso de información pública y siempre revelará su fuente de origen. Así mismo, publicará la información utilizada siempre y cuando esta no sea de carácter confidencial en los términos establecidos en la legislación colombiana.
PARÁGRAFO. La Secretaría Técnica de la Comisión podrá solicitar a cualquier miembro de la cadena de distribución, información necesaria para las labores de control y vigilancia de precios de dispositivos médicos.
ARTÍCULO 5o. PERÍODO DE REFERENCIA. Los datos utilizados serán los contemplados en las fuentes de información relacionadas en el artículo 4 de este acto, durante el período comprendido entre el 1 de enero y el 31 de diciembre del año inmediatamente anterior a la expedición del acto administrativo que regule los precios de los dispositivos médicos.
ARTÍCULO 6o. IDENTIFICACIÓN DE MERCADOS RELEVANTES. La Comisión a través de la Secretaría Técnica, cuando lo considere pertinente, realizará revisión y análisis de la información sobre el comportamiento de los precios, así como de los recobros de los dispositivos médicos, para identificar la necesidad de establecer nuevos mercados relevantes que sean sujetos a regulación de precios.
ARTÍCULO 7o. ETAPAS DE ANÁLISIS DE LOS MERCADOS DE DISPOSITIVOS MÉDICOS A INGRESAR A LIBERTAD VIGILADA. La metodología de análisis de los dispositivos médicos a ingresar a libertad vigilada consta de las siguientes etapas:
7.1. Identificación de aquellos dispositivos médicos que impactan la sostenibilidad del Sistema General de Seguridad Social en Salud (SGSSS), considerando, entre otros, aquellos con mayor participación en el valor total recobrado a la Administradora de los Recursos del Sistema General de Seguridad Social en Salud (ADRES). Estos dispositivos médicos se priorizarán, seleccionando aquellos con mayor participación en el valor de los cobros o recobros que conjuntamente acumulen entre el 50% y el 80% del valor total recobrado.
7.2. Definición del conjunto de productos relevantes para su inclusión al régimen de libertad vigilada.
7.3. Análisis a nivel nacional de los mercados relevantes; donde se consideran, entre otros, los siguientes criterios:
a) El total de oferentes y la concentración de mercado.
b) La pertenencia o no al Plan de Beneficios en Salud (PBS).
ARTÍCULO 8o. DETERMINACIÓN DEL CONJUNTO DE PRODUCTOS RELEVANTES PARA LA REGULACIÓN DE PRECIOS POR SU SUSTITUIBILIDAD TERAPÉUTICA Y/O FUNCIONAL. Para la regulación de precios, se entenderán como un conjunto de productos relevantes aquellos que sean sustituibles de forma terapéutica y/o funcional. Para esto se tendrá en cuenta:
8.1 Agrupaciones realizadas por nomencladores internacionales de dispositivos médicos o el estándar semántico adoptado por Colombia para dispositivos médicos de uso humano, cuando se haya establecido.
8.2. En caso de requerirse, se complementará la información con la revisión documental de las guías, manuales y recomendaciones de uso dadas por el fabricante del dispositivo médico.
8.3. Cuando se considere necesario, la Secretaría Técnica de la Comisión determinará las asociaciones profesionales y otros expertos del sector de los dispositivos médicos que se estén definiendo y realizará las acciones para consultar sus recomendaciones sobre el conjunto de productos relevantes, en cuyo caso las respuestas harán parte de las actas que evidencien las recomendaciones.
DISPOSITIVOS MÉDICOS ENDOVASCULARES CORONARIOS.
ARTÍCULO 9o. DISPOSITIVOS MÉDICOS EN EL RÉGIMEN DE LIBERTAD VIGILADA. Todos los dispositivos médicos endovasculares coronarios con registro sanitario otorgado por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) que se comercialicen a nivel nacional, se someten al régimen de libertad vigilada.
ARTÍCULO 10. DETERMINACIÓN DEL CONJUNTO DE PRODUCTOS RELEVANTES POR SUSTITUIBILIDAD TERAPÉUTICA Y/O FUNCIONAL. Los dispositivos médicos endovasculares coronarios se definen como un conjunto de productos relevantes.
ARTÍCULO 11. CONJUNTO DE DISPOSITIVOS MÉDICOS ENDOVASCULARES CORONARIOS. El conjunto de dispositivos médicos endovasculares coronarios se clasifica de la siguiente manera:
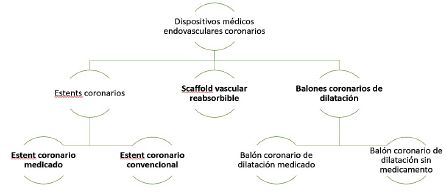
ARTÍCULO 12. MERCADOS RELEVANTES OBJETO DE ANÁLISIS. Los mercados relevantes objeto de análisis son los “estent coronarios”, los cuales a su vez se dividen en dos mercados relevantes: 1) “estent coronario convencional” y 2) “estent coronario medicado”.
ARTÍCULO 13. RÉGIMEN DE CONTROL DIRECTO DEL ESTENT CORONARIO MEDICADO. Todos los estent coronarios medicados que se comercialicen a nivel nacional se someten al régimen de control directo.
ARTÍCULO 14. APLICACIÓN DEL PRECIO MÁXIMO DE VENTA. El precio máximo de venta aplica para todas las operaciones de venta en las transacciones primaria y secundaria en el canal comercial, y las transacciones primaria, secundaria y final en el canal institucional.
ARTÍCULO 15. ESTABLECIMIENTO DEL PRECIO DE REFERENCIA NACIONAL (PRN) PARA LOS ESTENT CORONARIOS MEDICADOS. El Precio de Referencia Nacional es el precio expresado en unidad de medida, característico de un mercado relevante en Colombia. Se calcula como el promedio ponderado de los precios unitarios expresados en unidad de medida por las cantidades vendidas, utilizando la información de las transacciones finales institucionales reportadas al SISDIS para el período de referencia de que trata el artículo 5o de la presente circular, teniendo en cuenta los titulares de registro sanitario de los estent coronarios medicados que hagan parte de los mercados relevantes.
ARTÍCULO 16. APLICACIÓN DEL FACTOR DE AJUSTE PARA LOS ESTENT CORONARIOS. A los precios obtenidos de bases de datos de países de referencia que tengan información de precios en el punto exfábrica, se aplicará un factor de ajuste de 9%, para hacerlos comparables con la transacción final.
ARTÍCULO 17. ESTABLECIMIENTO DEL PRECIO DE REFERENCIA INTERNACIONAL (PRI) PARA EL ESTENT CORONARIO MEDICADO. El PRI corresponde al precio expresado en unidad de medida de acuerdo con el percentil 25 calculado a partir de los datos de precios de los países de referencia, cuando estén disponibles, y se establece de la siguiente manera:
17.1. Consulta de los precios internacionales: se consultará el precio del estent coronario medicado en las fuentes de información de los países de referencia definidos en el artículo 19 de la presente circular. De existir más de un precio para un país, se calculará el promedio simple de estos precios para determinar un precio por país.
17.2. Cálculo del Precio de Referencia Internacional (PRI): se calculará con base en el percentil 25 de los precios disponibles en los países de referencia y por unidad de medida para cada mercado relevante.
ARTÍCULO 18. TEMPORALIDAD DE LOS DATOS DE PRECIOS A OBSERVAR. Los precios, tanto nacionales como internacionales, utilizados para el análisis de los diferentes mercados de dispositivos médicos, serán aquellos correspondientes a la información más reciente disponible en las bases de datos consultadas. Esta información deberá corresponder con el período de referencia del que trata el artículo 5o de la presente circular.
ARTÍCULO 19. PAÍSES DE REFERENCIA INTERNACIONAL. Son los países a partir de los cuales la Comisión obtiene la información de los precios de dispositivos médicos, los cuales corresponden a los siguientes: Alemania, Argentina, Australia, Brasil, Canadá, Chile, Ecuador, España, Estados Unidos, Francia, Grecia, Italia, México, Panamá, Perú, Portugal, Reino Unido y Uruguay.
ARTÍCULO 20. NÚMERO DE PAÍSES PARA REFERENCIAR. La referenciación internacional deberá realizarse, por lo menos, con información de cuatro países de los mencionados en el artículo 19.
ARTÍCULO 21. TASA DE CAMBIO. Se utiliza para comparar los precios de dispositivos médicos obtenidos en los países de referencia internacional con los precios en el mercado nacional. En el marco de la presente metodología, para los precios expresados en una unidad monetaria distinta a pesos colombianos (COP), se tomará el promedio de venta y compra de la divisa publicada de manera diaria por el Banco de la República. Para establecer la tasa de cambio se calcula el promedio móvil con un rezago de 20 días de la tasa de cambio nominal para cada día del período de referencia, para luego establecer el promedio simple de los valores calculados de este periodo como la tasa de cambio a utilizar en la regulación. Para el cálculo del promedio móvil se utilizará la siguiente fórmula:
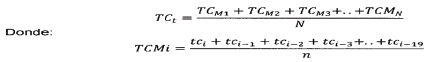
Siendo
TCt: Tasa de cambio a usar en la regulación.
TCMi: Tasa promedio de los últimos 20 días para el día i.
Tci Tasa de cambio en el día i.
N Número de días en el periodo de referencia (365).
N Número de días en el periodo de referencia (365).
: Número de días que se toma para calcular la tasa de cambio diaria.
ARTÍCULO 22. PRECIO MÁXIMO DE VENTA (PMV). El Precio Máximo de Venta (PMV) para los mercados relevantes sujetos a la aplicación de régimen de control directo de precios de dispositivos médicos corresponderá al menor valor entre el PRN y el PRI.
ARTÍCULO 23. PRECIO MÁXIMO DE VENTA PARA LOS ESTENTS CORONARIOS MEDICADOS. El Precio Máximo de Venta de los estents coronarios medicados es de dos millones ochocientos cincuenta y ocho mil cuatrocientos noventa y nueve con setenta y cinco centavos ($2.858.499,75) COP.
PARÁGRAFO. El precio máximo de venta para el estent coronario medicado se actualizará realizando una nueva referenciación internacional a la que se hace referencia el artículo 17 de la presente circular.
ARTÍCULO 24. PROHIBICIÓN DE INCREMENTAR EL PRECIO MÁXIMO DE VENTA POR INTERMEDIACIÓN. El Precio Máximo de Venta del estent coronario medicado, será el máximo permitido para realizar operaciones de venta en las transacciones primaria y secundaria en el canal comercial, y las transacciones primaria, secundaria y final en el canal institucional. Ningún actor podrá sobrepasar el precio regulado en el artículo 23 de la presente circular.
DISPOSITIVOS MÉDICOS ANTICONCEPTIVOS.
ARTÍCULO 25. DISPOSITIVOS MÉDICOS EN EL RÉGIMEN DE LIBERTAD VIGILADA. Todos los dispositivos anticonceptivos con registro sanitario otorgado por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) que se comercialicen a nivel nacional, se someten al régimen de libertad vigilada.
ARTÍCULO 26. CONJUNTO DE DISPOSITIVOS MÉDICOS ANTICONCEPTIVOS. El conjunto de dispositivos médicos anticonceptivos se clasifica de la siguiente manera:
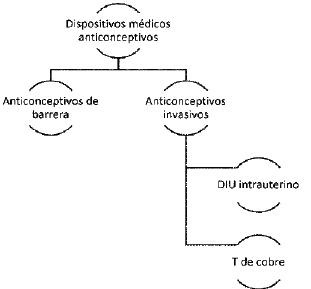
ARTÍCULO 27. EXCEPCIÓN. Si el anticonceptivo es usado en prestadores de servicios de salud para exámenes diagnósticos, no se aplica el régimen de libertad vigilada.
DE LOS DISPOSITIVOS MÉDICOS EN EL RÉGIMEN DE LIBERTAD VIGILADA.
ARTÍCULO 28. IMPLANTES AUDITIVOS DE CONDUCCIÓN ÓSEA A RÉGIMEN DE LIBERTAD VIGILADA. El conjunto de dispositivos médicos implantes auditivos de conducción ósea con registro sanitario otorgado por el Invima que se comercialicen a nivel nacional, se someten al régimen de libertad vigilada. Estos se clasifican de la siguiente manera:
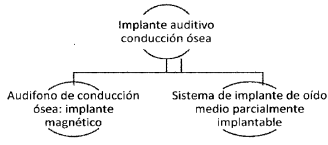
El dispositivo médico suministrado en el primer procedimiento del sistema quirúrgico de implante auditivo de conducción ósea se deberá reportar en el SISDIS, en los términos previstos en la Sección VI de la presente circular. También se deberán reportar los casos en los que se realice cambio total de componentes, pero no cuando realicen los actores otros tipos de suministro de este dispositivo médico.
ARTÍCULO 29. DISPOSITIVOS MÉDICOS DE IMPLANTE PARA CORNEA EN EL RÉGIMEN DE LIBERTAD VIGILADA. El conjunto de dispositivos médicos de implantes para córnea con registro sanitario otorgado por el Invima que se comercialicen a nivel nacional se somete al régimen de libertad vigilada y se clasifican de la siguiente manera:
ARTÍCULO 30. DISPOSITIVOS MÉDICOS PARA IMPLANTE COCLEAR EN EL RÉGIMEN DE LIBERTAD VIGILADA. Los implantes cocleares con registro sanitario otorgado por el Invima que se comercialicen a nivel nacional se someten al régimen de libertad vigilada.
El dispositivo médico suministrado en el primer procedimiento del sistema quirúrgico de implante coclear se debe reportar en el SISDIS. También se deberán reportar, los casos en los que se realice cambio total de componentes, pero no otros tipos de suministro de este dispositivo médico, que realicen los actores.
ARTÍCULO 31. DISPOSITIVOS MÉDICOS IMPLANTABLES PARA TERAPIA CARDIACA DE ALTO VOLTAJE EN EL RÉGIMEN DE LIBERTAD VIGILADA. El conjunto de dispositivos médicos implantables para terapia cardiaca de alto voltaje con registro sanitario otorgado por el Invima que se comercialicen a nivel nacional se somete al régimen de libertad vigilada y se clasifica de la siguiente manera:
SISTEMA DE INFORMACIÓN DE PRECIOS DE DISPOSITIVOS MÉDICOS (SISDIS).
ARTÍCULO 32. SISTEMA DE INFORMACIÓN DE PRECIOS DE DISPOSITIVOS MÉDICOS (SISDIS). Conjunto de componentes interrelacionados que trabajan juntos para recopilar, procesar, almacenar y difundir información sobre precios de los dispositivos médicos, incluidos en los regímenes de libertad vigilada, libertad regulada o control directo, que se comercialicen en el territorio nacional. El reporte en SISDIS se realiza en la Plataforma de Intercambio de Información -PISIS del Sistema Integral de Información de la Protección Social (SISPRO).
Este sistema tendrá como objetivo:
32.1 Proveer la información necesaria a la Comisión, a su grupo técnico asesor (GTA) y a las entidades de control.
32.2 Normalizar el registro, almacenamiento, flujo, transferencia y disposición de la información para la regulación del mercado de dispositivos médicos en toda la cadena de producción, importación y distribución.
32.3 Contribuir a la disminución de las asimetrías de información existentes en el sector, a través de la disposición y uso de información uniforme, integrada y de calidad.
32.4. Facilitar el acceso a la información no reservada sobre precios de dispositivos médicos a los actores del Sistema General de Salud y al público en general, en armonía con las políticas del Gobierno en esta materia.
ARTÍCULO 33. REPORTE EN SISDIS. Los fabricantes o importadores de los dispositivos médicos que cuenten con registro sanitario expedido por el Invima y hayan sido incorporados al régimen de libertad vigilada, regulada o control directo y quienes comercialicen o suministren dichos dispositivos, serán responsables de efectuar el reporte de precios, en las transacciones correspondientes, a través de Sistema de Información de Precios de Dispositivos Médicos (SISDIS), de conformidad con el anexo técnico que forma parte de la presente circular.
Las instituciones prestadoras de salud (IPS) deberán reportar ante el SISDIS, todas las transacciones realizadas con dispositivos médicos sujetos al régimen de control directo, libertad regulada o libertad vigilada sobre los que exista obligación de reportar.
PARÁGRAFO. Los establecimientos farmacéuticos minoristas, esto es, farmacias/droguerías y droguerías del canal comercial, no deberán realizar el reporte en ninguna transacción.
ARTÍCULO 34. INFORMACIÓN PARA REPORTAR EN SISDIS. Los actores establecidos en el artículo 33, deberán reportar de cada dispositivo médico incorporado al régimen de libertad vigilada, regulada o control directo, la información que se encuentra detallada en el Anexo Técnico que hace parte de la presente circular.
Los fabricantes o importadores de los dispositivos médicos que cuenten con registro sanitario expedido por el Invima y que hayan sido incorporados a los regímenes de libertad vigilada, regulada o control directo que no realicen ventas durante el periodo de reporte, deberán realizar el reporte en ceros. Los actores diferentes al fabricante o importador no requieren realizar el reporte en ceros.
En el caso que la operación de compra, venta, recobro/cobro sea realizada en el marco de un procedimiento médico, los obligados deberán reportar únicamente en el SISDIS el precio del dispositivo médico suministrado, el cual deberá coincidir con el valor que se encuentra registrado en la factura reportada.
PARÁGRAFO. En ningún caso se deben reportar notas crédito, muestras médicas ni donaciones.
ARTÍCULO 35. PERÍODO DEL REPORTE. El reporte de información se deberá realizar trimestralmente discriminando las operaciones y transacciones para cada mes en los plazos máximos previstos en el siguiente calendario:
| Fecha de corte de la información a reportar | Meses que deben reportarse | Plazo para enviar el archivo plano | |
| Desde | Hasta (Fecha máxima de reporte) | ||
| 31 de marzo | Enero, febrero y marzo del respectivo año. | Primer día hábil de abril | Último día hábil de abril |
| 30 de junio | Abril, mayo, y junio del respectivo año. | Primer día hábil de julio | Último día hábil de julio |
| 30 de septiembre | Julio, agosto y septiembre del respectivo año. | Primer día hábil de octubre | Último día hábil de octubre |
| 31 de diciembre | Octubre, noviembre y diciembre del respectivo año. | Primer día hábil de enero del año siguiente | 15 de febrero del año siguiente o en caso de no ser un día hábil, el día hábil siguiente |
PARÁGRAFO. La secretaría técnica de la Comisión habilitará dos veces al año el SISDIS para el reporte de casos extemporáneos así: del 1 al 21 de mayo y la segunda del 1 al 21 de noviembre, de cada vigencia; sin perjuicio de las sanciones a las que haya lugar.
ARTÍCULO 36. RESPONSABILIDADES FRENTE A LA INFORMACIÓN CONTENIDA EN EL SISDIS. Los actores del Sistema General de Seguridad Social en Salud que participen en el flujo y consolidación de la información serán responsables de la privacidad, seguridad, confidencialidad y veracidad de la información suministrada y sobre los datos de los cuales se tiene acceso.
ARTÍCULO 37. SOPORTE Y ASISTENCIA TÉCNICA. El Ministerio de Salud y Protección Social dispondrá la Mesa de Ayuda de PISIS, cuyo detalle de operación se especifica en el Anexo Técnico de la presente circular.
ARTÍCULO 38. DESHABILITACIÓN DEL ANEXO TÉCNICO DE SISDIS EN LA PLATAFORMA PISIS. Los actores obligados a reportar en SISDIS, podrán solicitar su deshabilitación en el sistema, adjuntando la justificación y la evidencia.
ARTÍCULO 39. REPORTES VÁLIDOS. Sólo se aceptarán y considerarán válidos los reportes de información enviados a través de la plataforma PISIS, de acuerdo con el anexo y técnico contenido en la presente circular.
Durante los periodos señalados en el artículo 35 de esta circular, se podrán cargar los archivos de reporte a la plataforma PISIS, las veces que sean necesarias. El último archivo enviado a la plataforma y con confirmación de reporte, se entenderá como el archivo final conforme a la obligación establecida para los actores en el artículo 33 de la presente circular.
PARÁGRAFO. Las tablas actualizadas con los valores permitidos se podrán consultar en la opción “Tablas de referencia” en web.sispro.gov.co.
ARTÍCULO 40. CONFIRMACIÓN DE REPORTE. Se entenderá cumplida la obligación de reportar la información de precios de dispositivos médicos, una vez SISPRO emita una notificación indicando que fue cargada de acuerdo con las especificaciones contenidas en el anexo técnico.
DISPOSICIONES FINALES.
ARTÍCULO 41. SOLICITUD DE INFORMACIÓN. La Secretaría Técnica de la Comisión podrá solicitar en cualquier momento y a cualquier miembro de la cadena de distribución, la información necesaria para efectos de monitoreo y control de precios de dispositivos médicos.
ARTÍCULO 42. SANCIONES POR EL INCUMPLIMIENTO DE LO ESTABLECIDO EN LA PRESENTE CIRCULAR. La inobservancia de las instrucciones contenidas en la presente circular constituye una violación al régimen aplicable al control de precios de medicamentos y dispositivos médicos, y, por lo tanto, su incumplimiento estará sujeto a las multas contempladas en el artículo 132 de la Ley 1438 de 2011, sin perjuicio de las demás sanciones a que haya lugar.
ARTÍCULO 43. TRATAMIENTO Y SEGURIDAD DE LA INFORMACIÓN. Las entidades que participen en el flujo y consolidación de la información, serán responsables del cumplimiento del régimen de protección de datos y demás aspectos relacionados con el tratamiento de información, que le sea aplicable en el marco de la Ley Estatutaria 1581 de 2012, de la Ley 1712 de 2014, así como las demás disposiciones concordantes en la materia, en virtud de lo cual se hacen responsables de la privacidad, seguridad, confidencialidad y veracidad de la información suministrada y de los datos personales sobre los cuales se tiene acceso.
PARÁGRAFO. Para garantizar la seguridad y veracidad de la información reportada, las entidades deben enviar los archivos firmados digitalmente, lo cual los protege garantizando su confidencialidad, integridad y no repudio. Para firmar digitalmente los archivos, se debe usar un certificado digital emitido por una entidad certificadora abierta aprobada por la entidad competente.
ARTÍCULO 44. PLAN PILOTO DEL SISTEMA DE INFORMACIÓN DE PRECIOS DE DISPOSITIVOS MÉDICOS – SISDIS. Los actores a los que aplica esta circular contarán con un período de prueba que se extiende hasta el 30 de septiembre del presente año, en el cual podrán reportar de forma pedagógica en cualquier momento, la información del segundo trimestre del año 2023, de conformidad con lo establecido en el anexo técnico adoptado mediante este acto y con el acompañamiento de la secretaria técnica de la Comisión.
ARTÍCULO 45. TRANSITORIEDAD. Los actores obligados a reportar deberán hacerlo desde el primer día hábil y hasta el último día hábil de octubre del presente año, atendiendo al anexo técnico de la presente circular y corresponderá a la información del segundo trimestre (abril, mayo, junio) y tercer trimestre (julio, agosto, septiembre) del 2023. Los reportes de los siguientes trimestres, se realizarán de conformidad con lo establecido en el artículo 35 de la presente circular.
ARTÍCULO 46. VIGENCIA Y DEROGATORIA. La presente circular rige a partir de la fecha de su publicación en el Diario Oficial y deroga la Circular número 14 de 2022.
Publíquese y cúmplase.
Dada en Bogotá, D. C., a 28 de julio de 2023.
El Ministro de Salud y Protección Social,
Guillermo Alfonso Jaramillo Martínez.
El Ministro de Comercio, Industria y Turismo,
Darío Germán Umaña Mendoza.
El Delegado del Presidente de la República,
Stalin Ballesteros García.
REPORTE DE INFORMACIÓN DE PRECIOS DE DISPOSITIVOS MÉDICOS INCORPORADOS AL RÉGIMEN DE LIBERTAD VIGILADA, REGULADA O CONTROL DIRECTO.
Las entidades obligadas a reportar definidas en la presente circular deben enviar al Ministerio de Salud y Protección Social los archivos planos con la información de precios de dispositivos médicos. Para este anexo técnico se definen cuatro capítulos:
1. ESTRUCTURA Y ESPECIFICACIÓN DE LOS ARCHIVOS.
2. CARACTERÍSTICAS DE LOS ARCHIVOS PLANOS.
3. PLATAFORMA PARA EL ENVÍO DE ARCHIVOS.
3. PERIODO DE REPORTE Y PLAZO.
1. ESTRUCTURA Y ESPECIFICACIÓN DE LOS ARCHIVOS
a) Estructura y especificación del nombre del archivo.
El nombre de los archivos de la información de precios de dispositivos médicos debe ser enviada por los actores enunciados en el artículo 33 de la presente Circular, debe cumplir con el siguiente estándar:
| Componente del nombre de archivo | Valores permitidos o formato | Descripción | Longitud fija | Requerido |
| Módulo de información | DIS | Identificador del módulo de información | 3 | SÍ |
| Tipo de fuente | 123 | Fuente de la información | 3 | SÍ |
| Tema de información | DVEN | Información de precios de dispositivos médicos | 4 | SÍ |
| Fecha de corte | AAAAMMDD | Fecha de corte de la información reportada. Es el último día calendario del período de información reportada. No se debe utilizar ningún tipo de separador. Ejemplo: 20210331 | 8 | SÍ |
| Tipo de identificación de la entidad que reporta | ZZ | Tipo de identificación del actor que reporta la información. - Si es un actor diferente a entidad territorial: se debe especificar NI correspondiente al tipo de identificación Número de Identificación Tributaria (NIT). - Si corresponde a una Dirección Territorial del orden Departamental: se debe especificar DE - Si corresponde a una Dirección Territorial del orden Distrital: se debe especificar Dl - Si corresponde a una Dirección Territorial del orden municipal: se debe especificar MU. | 2 | SÍ |
| Número de identificación de la entidad que reporta | 999999999999 | Número de identificación del actor que envía los archivos, de acuerdo con el tipo de identificación del campo anterior: - Número de NIT sin incluir el dígito de verificación para tipo de Identificación NI. Para el caso de las entidades territoriales, en este campo va el código DANE. - Si es DE en este campo va el código DANE del departamento. Ejemplo 000000000025 Si es DI en este campo va el código DANE del Distrito. Ejemplo 000000011001 - Si es MU en este campo va el código DANE del municipio. Ejemplo 000000025001 Sin excepción, se debe usar el carácter CERO de relleno a la izquierda si es necesario para completar el tamaño del campo. Ejemplo: 000860999123 Nota: cuando los obligados a reportar tengan sucursales, el reporte de cada una de ellas debe reunirse y consolidarse en un solo archivo. Tal consolidado debe enviarse por un único actor, bajo un solo NIT | 12 | SÍ |
| Extensión del archivo | .TXT | Extensión del archivo plano. Si es un archivo plano.txt | 4 | SÍ |
NOMBRE DEL ARCHIVO
| Tipo de archivo | Nombre de archivo | Longitud |
| Reporte de información de precios de dispositivos médicos | DIS123DVENAAAAMMDDZZ999999999999.txt | 36 |
b) Contenido del archivo
A continuación, algunas consideraciones para el contenido de los archivos
El archivo de la información de precios de dispositivos médicos está compuesto por un único registro de control (Registro Tipo 1) utilizado para identificar el actor fuente de la información y varios tipos de registros de detalle numerados a partir del Registro Tipo 2, que contienen la información solicitada, así:
| Registro | Descripción | Reporte |
| Tipo 1 | Registro de control | Obligatorio |
| Tipo 2 | Registro de detalle de precios de compra, venta y recobro | Obligatorio |
Cada registro está conformado por campos, los cuales se separan por pipe (|)
b.1. REGISTRO TIPO 1 REGISTRO DE CONTROL
Es obligatorio. Es el primer registro que debe aparecer en los archivos que sean enviados.
| No. | Nombre del campo | Longitud máxima del campo | Tipo | Valores permitidos | Requerido |
| 0 | Tipo de registro | 1 | N | 1: valor que significa que el registro es de control | SÍ |
| 1 | Tipo de identificación de la entidad que reporta | 2 | A | ZZ - Si es una entidad diferente a entidad territorial: se debe especificar NI correspondiente al tipo de identificación NIT - En el caso de que las entidades territoriales reporten, se especifica de la siguiente manera: - MU: Municipio - DE: Departamento - DI: Distrito | SÍ |
| 2 | Número de identificación de la entidad que reporta | 12 | N | Número de identificación de la entidad que envía los archivos, de acuerdo con el tipo de identificación del campo anterior. - Número de NIT sin incluir el digito de verificación para tipo de Identificación NI. - Para el caso de las entidades territoriales, en este campo va el código DIVIPOLA DANE. - Si es DE en este campo va el código DANE del departamento. Ejemplo: 25 - Si es DI en este campo va el código DANE del Distrito. Ejemplo: 11001 Si es MU en este campo va el código DANE del municipio. Ejemplo: 25001 | SÍ |
| 3 | Fecha inicial del período de la información reportada | 10 | F | En formato AAAA-MM-DD. Debe corresponder a la fecha de inicio del período de información reportada. Ejemplo fecha válida: 2021-01-01 | SÍ |
| 4 | Fecha final del período de la información reportada | 10 | F | En formato AAAA-MM-DD. Debe corresponder a la fecha final del periodo de información reportada y debe concordar con la fecha de corte del nombre del archivo. Último día calendario del mes o periodo que se está reportando. Ejemplo de fecha válida: 2021-03-31 | SÍ |
| 5 | Número total de registros de detalle contenidos en el archivo | 10 | N | Debe corresponder a la cantidad de registros tipo 2, contenidos en el archivo. Si existen más registros será la suma de todos los registros. | SÍ |
b.2 REGISTRO TIPO 2 – REGISTRO DE DETALLE DE PRECIOS DE VENTA, COMPRA Y RECOBRO DE DISPOSITIVOS MÉDICOS
Mediante el Registro Tipo 2, los actores reportan el detalle de la información de las operaciones (compra, venta y recobro/cobro) mensuales, discriminando por transacción para cada dispositivo médico. Los registros se identifican de manera única mediante los campos 2 (código de habilitación), campo 3 (mes de la información), campo 4 (canal), campo 5 (Rol del actor respirante frente a la operación del reporte del dispositivo médico), campo 6 (tipo de operación), campo 7 (tipo de transacción), campo 8 (identificador de dispositivo médico) y campo 9 (unidad en la que se factura el dispositivo médico).
| No. | Nombre del campo | Longitud máxima del campo | Tipo | Valores permitidos | Requerido |
| 0 | Tipo de registro | 1 | N | 2: valor que significa que el registro es de detalle. | SÍ |
| 1 | Consecutivo de registro | 10 | N | Número consecutivo de registros de detalle dentro del archivo. Inicia en 1 para el primer registro de detalle y va incrementando de 1 en 1, hasta el final del archivo. | SÍ |
| 2 | Código de habilitación | 10 | N | Cada prestador de servicios de salud inscrito en el Registro Especial de Prestadores de Servicios de Salud (REPS), deberá unificar la información de precios a nivel de la entidad territorial, incluyendo cada una de las sedes de su jurisdicción asociadas al mismo código de prestador entregado por REPS. Luego de consolidar por entidad territorial, se deberáí allegar esta información para el reporte bajo un único NIT en un solo archivo plano, reportando para cada código de habilitación una línea diferente. Se deberáí incluir, en este campo, los primeros 10 dígitos del código de habilitación del prestador de servicios de salud, según se le haya asignado en el REPS. En caso de no tener código de habilitación, según normatividad vigente, se debe diligenciar este campo con cero (0). En caso de ser prestador de servicios de salud que está reportando transacciones como actor tipo 1, el código de habilitación debe ser diligenciado con cero (0). Los códigos de habilitación y el NIT del reportante deben coincidir con REPS y el NIT del registro de control. | SÍ |
| 3 | Mes de la información a reportar | 2 | N | Corresponde al mes en el cual se efectuóí la transacción del dispositivo médico de acuerdo con la factura. Debe corresponder a un mes válido perteneciente al trimestre que se está reportando. Ejemplo: 03(marzo), 04 (abril). | SÍ |
| 4 | Canal | 3 | A | Dato usado para discriminar las ventas, compras y cobros/recobros de los dispositivos médicos por el canal de distribución institucional y comercial. Los valores permitidos son: INS: institucional COM: comercial. Se debe validar contra la tabla de referencia SISMED canal en web sispro.gov.co | SÍ |
| 5 | Rol del actor que reporta frente a la operación de reporte del dispositivo médico | 1 | N | Tipo de actor que reporta la información. Puede tomar el valor de: 1. Actor, que fabrica o importa el dispositivo médico a reportar. 2. Actor que participa en la cadena de comercialización pero que no elabora, ni importa, ni suministra o ni usa el dispositivo médico a reportar. 3. Actor que suministra o usa el dispositivo médico. En todos los casos el actor tipo 3 debe tener un código de habilitación. En caso de ser prestador de servicios de salud que está reportando transacciones como actor tipo 1, el código de habilitación debe ser diligenciado con cero (0). Se debe validar contra la tabla de referencia DISRolreportante | SÍ |
| 6 | Tipo de operación | 2 | A | Corresponde al tipo de operación realizada por el actor reportante. Si el valor reportado en el campo 5, corresponde a “1”, este campo puede tomar el valor de: - VN: operación de venta Si el valor reportado en el campo 5, corresponde a “2” o “3”, este campo puede tomar el valor de: - VN: operación de venta - CM: operación de compra - RC: operación de cobro/recobro Se debe validar contra la tabla MEDTipoOperacion | SÍ |
| 7 | Tipo de transacción | 2 | A | Corresponde al tipo de transacción realizada por el actor reportante. Este campo puede tomar el valor de: 01- Transacción primaria 02- Transacción secundaria 03- Transacción final Se debe validar contra la tabla de referencia DISTipoTransaccion | SÍ |
| No. | Nombre del campo | Longitud máxima del campo | Tipo | Valores permitidos | Requerido |
| 8 | Identificador del dispositivo médico | 12 | A | Es un código, identificador para los Dispositivos Médicos sujetos a reporte, según su presentación comercial y referencia. Ver la tabla de referencia “DispositivosMedicosLibertadVigilada” en la página web sispro.gov. co, donde encontraraílos códigos asignados. En caso de que algún dispositivo médico incorporado al régimen de libertad vigilada no se encuentre en la tabla de referencia “DispositivosMedicosLibertadVigilada”, se debe enviar la alerta con el número de expediente o el registro sanitario al correo sisdis@minsalud.gov.co | SÍ |
| 9 | Unidad en la que se factura el dispositivo médico en la operación reportada | 1 | A | Hace referencia a la unidad en la cual se van a reportar los siguientes campos: (10) Total de unidades (12) Precio unitario mínimo (13) Precio unitario máximo En el caso que el reporte se haga por presentación comercial, el valor permitido en este campo es: A: Presentación comercial En el caso que el reporte se realice por: Unidad mínima de dispensación o uso, el valor permitido es: B: Unidad mínima de dispensación o uso. Ejemplo: Un (1) estent coronario, un (1) condón. Se aclara que la Unidad en la que se debe realizar el reporte, debe coincidir con la Unidad en la que se factura el dispositivo médico para cada una de las operaciones reportadas al SISDIS. | SÍ |
| 10 | Total de unidades de reporte en el mes para la operación y la transacción | 7 | N | Cantidad total de unidades en la que se factura el dispositivo médico en el mes para la transacción y operación que se estáí reportando. Este campo debe ser mayor o igual a cero. | SÍ |
| 11 | Valor del total facturado del dispositivo médico durante el mes para la operación y transacción del reporte | 16 | D | Suma en pesos colombianos del valor total facturado del dispositivo médico durante el mes para la operación y transacción reportada. El campo permite hasta dos cifras decimales, utilizando el separador de punto (.). | SÍ |
| 12 | Precio unitario mínimo del dispositivo médico durante el mes para la operación y la transacción del reporte | 16 | D | Precio mínimo en pesos colombianos de la unidad en la que se factura el dispositivo médico, de aquellos facturados durante el mes, para la operación y transacción reportada. El campo permite hasta dos cifras decimales, utilizando el separador de punto (.). Este campo debe ser igual o menor que el campo 13. Debe tenerse en cuenta que el reporte se realiza por unidad en la que se factura el dispositivo médico definida en el campo 9. | SÍ |
| 13 | Precio unitario máximo del dispositivo médico durante el mes para la operación y transacción del reporte | 16 | D | Precio máximo en pesos colombianos de la unidad en la que se factura el dispositivo médico, de aquellos facturados durante el mes, para la operación y transacción reportada. El campo permite hasta dos cifras decimales, utilizando el separador de punto (.). Este campo debe ser igual o mayor que el campo 12. En el caso de haber en el mes una sola operación y transacción del reporte, este campo deberáí ir igual al campo doce donde se reporta el precio unitario mínimo. Debe tenerse en cuenta que el reporte se realiza por la unidad en la que se factura el dispositivo médico definida en el campo 9. | SÍ |
| 14 | Tipo de identificación del actor con quien se realizó la operación y la transacción de reporte, al precio mínimo | 2 | A | - Si es una entidad diferente a entidad territorial: se debe especificar NI correspondiente al tipo de identificación NIT - En el caso de que las entidades territoriales reporten, se especifica de la siguiente manera: - MU: Municipio - DE: Departamento - DI: Distrito - En caso de que el actor corresponda a una persona natural se debe especificar: PN. | SÍ |
| 15 | Número de identificación del actor con quien se realizó la operación y la transacción de reporte, al precio mínimo | 12 | N | Número de identificación del actor con quien se realizó la operación y transacción para el mes de reporte en la factura de menor valor. Si el documento de identificación no se encuentra en SISPRO, este generará una alerta, sin embargo, se admitirá el cargue del archivo. - Número de NIT sin incluir el digito de verificación para tipo de Identificación NI. - Para el caso de las entidades territoriales, en este campo va el código DIVIPOLA DANE. Si es DE en este campo va el código DANE del departamento. Ejemplo: 25 - Si es DI en este campo va el código DANE del Distrito. Ejemplo: 11001 - Si es MU en este campo va el código DANE del municipio. Ejemplo: 25001 - Para el caso de personas naturales (PN) ingresar un cero. | SÍ |
| 16 | Número de factura o documento equivalente del precio mínimo unitario de la operación y transacción del reporte | 20 | A | Número de la factura o documento equivalente que evidencia el precio mínimo reportado en el campo 12. En caso de que la transacción se haya realizado a través de un contrato, se debe reportar con el número de éste. | SÍ |
| 17 | Tipo de identificación del actor con quien se realizó la operación y la transacción de reporte, al precio máximo | 2 | A | -Si es una Entidad diferente a entidad territorial: se debe especificar NI correspondiente al tipo de identificación NIT - En el caso de que las entidades territoriales reporten, se especifica de la siguiente manera: - MU: Municipio - DE: Departamento - DI: Distrito - En caso de que el actor corresponda a una persona natural se debe especificar: PN | SÍ |
| 18 | Número de identificación del actor con quien se realizó la operación y transacción de reporte, al precio máximo. | 12 | N | Número de identificación del actor con quien se realizó la operación y transacción para el mes de reporte en la factura de mayor valor. Si el documento de identificación no se encuentra en SISPRO, este generará una alerta, sin embargo, se admitirá el cargue del archivo. - Número de NIT sin incluir el digito de verificación para tipo de Identificación NI. - Para el caso de las entidades territoriales, en este campo va el código DIVIPOLA DANE. - Si es DE en este campo va el código DANE del departamento. Ejemplo: 25 - Si es DI en este campo va el código DANE del Distrito. Ejemplo: 11001 - Si es MU en este campo va el código DANE del municipio. Ejemplo: 25001 - Para el caso de personas naturales (PN) ingresar un cero | SÍ |
| 19 | Número de factura o documento equivalente del precio máximo unitario de la operación y transacción del reporte | 20 | A | Número de la factura o documento equivalente que evidencia el precio reportado en el campo 13. En caso de que la transacción se haya realizado a través de un contrato, se debe reportar con el número de éste. | SI |
Aclaraciones:
1. En el caso en que se registren descuentos comerciales en las facturas del mes, para la operación y transacción respectiva, únicamente se debe reportar los precios finales que se encuentran facturados.
2. Las unidades bonificadas no deberán considerarse para el reporte.
3. Se aclara que en las operaciones en las que la factura no indique el valor del dispositivo médico, se debe reportar en el campo correspondiente el número de contrato o documento equivalente el cual se evidencie el dispositivo médico objeto de reporte y su respectivo precio especificado.
4. Con el fin de que las auditorías realizadas por los entes de control puedan dar cuenta de los precios reportados para los dispositivos médicos que sean comercializados o dispensados por concepto de contratos, el actor obligado a reportar deberá contar con el soporte documental que indique el precio de referencia por valor unitario de cada dispositivo médico reportado.
Las facturas asociadas a operaciones de maquila o traspasos de inventario no deben ser consideradas en las facturas objeto de reporte.
1. CARACTERÍSTICAS DE LOS ARCHIVOS PLANOS
Los archivos deben ser tipo texto y cumplir con las siguientes especificaciones técnicas:
a) En el anexo técnico de los archivos, el tipo de dato, corresponde a los siguientes:
A.-Alfanumérico N-Númérico D-decimal F-Fecha T-Texto con caracteres especiales
b) Todos los datos deben ser grabados como texto en archivos planos de formato ANSI, con extensión.txt
c) Los nombres de archivos y los datos de estos deben ser grabados en letras MAYÚSCULAS, sin caracteres especiales y sin tildes.
d) El separador de campos debe ser pipe (|) y debe ser usado exclusivamente para este fin. Los campos que corresponden a descripciones no deben incluir el carácter especial pipe (|).
e) Cuando dentro de un archivo de datos se definan campos que no son obligatorios y que no sean reportados, este campo no llevará ningún valor, es decir debe ir vacío y reportarse en el archivo entre dos pipes, por ejemplo, si entre el dato1 y el dato3, el dato2 está vacío se reportará así: dato1||dato3.
f) Ningún dato en el campo debe venir encerrado entre comillas (“”) ni ningún otro carácter especial.
g) Los campos numéricos deben venir sin ningún formato de valor ni separación de miles. Para los campos que se permita valores decimales, se debe usar el punto como separador de decimales.
h) Los campos de tipo fecha deben venir en formato AAAA-MM-DD incluido el carácter guion, a excepción de las fechas que hacen parte del nombre de los archivos.
i) Las longitudes de campos definidas en los registros de control y detalle de este anexo técnico se deben entender como el tamaño máximo del campo, es decir que los datos pueden tener una longitud menor al tamaño máximo.
j) Los valores registrados en los archivos planos no deben tener ninguna justificación, por lo tanto no se les debe completar con ceros ni espacios.
k) Tener en cuenta que cuando los códigos traen CEROS, estos no pueden ser remplazados por la vocal 'O' la cual es un carácter diferente a cero.
l) Los archivos planos no deben traer ningún carácter especial de fin de archivo ni de final de registro. Se utiliza el ENTER como fin de registro
m) Los archivos deben estar firmados digitalmente.
2. PLATAFORMA PARA EL ENVÍO DE ARCHIVOS
El Ministerio de Salud y Protección Social dispondrá de la Plataforma de Intercambio de Información (PISIS) del Sistema Integral de Información de la Protección Social- SISPRO, para que las entidades reporten la información desde sus instalaciones. Primero se registra o actualiza la entidad en el Sitio Web del SISPRO y luego se registran los usuarios de la entidad.
Registrar entidad:
https://web.sispro.gov.co/Entidades/Cliente/VerificarEstadoRegistro
Registrar usuarios institucionales: se pueden registrar en línea o mediante anexo técnico por PISIS.
Registro de usuarios institucionales en línea:
https://web.sispro.gov.co/Seguridad/Cliente/Web/RegistroSolicitudes.aspx
Registro de usuarios institucionales mediante Anexo Técnico SEG500USIN por PISIS:
El procedimiento se encuentra detallado en la Guía de Usuario de Seguridad en https:// web.sispro.gov.co
Control de calidad de los datos
La Plataforma PISIS recibe los archivos conformados según la estructura del presente Anexo Técnico determinado en este acto administrativo y realiza el proceso de validación, así:
- Primera validación: corresponde a la revisión de la estructura de los datos y se informa el estado de la recepción al reportante.
- Segunda validación: Una vez realizada en forma exitosa la primera validación se realiza el control de calidad de contenido en el aplicativo misional y se informa al reportante el resultado.
Se entiende cumplida la obligación de este reporte una vez la segunda validación sea exitosa.
Mesa de ayuda
Con el propósito de brindar ayuda técnica para el reporte de los archivos, transporte de datos y demás temas relacionados, el Ministerio de Salud y Protección Social tiene dispuesta una mesa de ayuda. Los datos de contacto se encuentran en el siguiente enlace:
https://www.sispro.gov.co/ayudas/Pages/Ayudas.aspx.
Adicionalmente, se dispone de documentación para el uso de la plataforma PISIS en el siguiente enlace: https://web.sispro.gov.co/WebPublico/Soporte/FAQ/FAQ. aspx
3. PERIODO DE REPORTE Y PLAZO
El reporte de la información deberá realizarse trimestralmente discriminando las operaciones y transacciones para cada mes en los plazos máximos previstos en el siguiente calendario.
| Fecha de corte de la Información a reportar | Meses que deben reportarse | Plazo para enviar el archivo plano | |
| Desde: | Hasta: (Fecha máxima de reporte) | ||
| 31 de marzo | Enero, febrero y marzo del respectivo año | Primer día hábil de abril | Último día hábil de abril |
| 30 de junio | Abril, mayo, y junio del respectivo año | Primer día hábil de julio | Último día hábil de julio |
| 30 de septiembre | Julio, agosto y septiembre del respectivo año. | Primer día hábil de octubre | Último día hábil de octubre |
| 31 de diciembre | Octubre, noviembre y diciembre del respectivo año. | Primer día hábil de enero del año siguiente | 15 de febrero del año siguiente o en caso de no ser un día hábil, el día hábil siguiente |
Las notas de vigencia, concordancias, notas del editor, forma de presentación y disposición de la compilación están protegidas por las normas sobre derecho de autor. En relación con estos valores jurídicos agregados, se encuentra prohibido por la normativa vigente su aprovechamiento en publicaciones similares y con fines comerciales, incluidas -pero no únicamente- la copia, adaptación, transformación, reproducción, utilización y divulgación masiva, así como todo otro uso prohibido expresamente por la normativa sobre derechos de autor, que sea contrario a la normativa sobre promoción de la competencia o que requiera autorización expresa y escrita de los autores y/o de los titulares de los derechos de autor. En caso de duda o solicitud de autorización puede comunicarse al teléfono 617-0729 en Bogotá, extensión 101. El ingreso a la página supone la aceptación sobre las normas de uso de la información aquí contenida.