



RESOLUCIÓN 3311 DE 2018
(agosto 3)
Diario Oficial No. 50.678 de 7 de agosto de 2018
MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL
Por la cual se define el estándar de datos de medicamentos de uso humano en Colombia y se dictan otras disposiciones.
EL MINISTRO DE SALUD Y PROTECCIÓN SOCIAL,
en ejercicio de sus facultades legales, en especial de las contenidas en el numeral 9 del artículo 2o del Decreto-ley 4107 de 2011, y
CONSIDERANDO:
Que la Ley Estatutaria 1751 de 2015 en su artículo 6o contempla que el derecho fundamental a la salud incluye, entre otros elementos esenciales e interrelacionados, la accesibilidad a los servicios y tecnologías de salud y en el inciso final del artículo 19 ib, dispuso que los agentes del Sistema deben suministrar la información que requiera este Ministerio en los términos y condiciones que se determine.
Que el artículo 4o de la Ley 1753 de 2015 “por la cual se expide el Plan Nacional de Desarrollo 2014-2018 “todos por un nuevo país”, estableció en su artículo 4o, como una de las estrategias transversales, la competitividad e infraestructura estratégica; en ese sentido, como una estrategia transversal, el estándar de datos de medicamentos es un mecanismo para facilitar el intercambio de información farmacéutica y dinamizar el sector salud.
Que, por otra parte, la Resolución 429 de 2016 expedida por este Ministerio, por medio de la cual se adopta la Política de Atención Integral en Salud (PAIS), en su artículo 3o establece un modelo operacional denominado Modelo de Atención Integral en Salud (MIAS) que, a partir de las estrategias definidas, adopta herramientas para garantizar la oportunidad, continuidad, integralidad, aceptabilidad y calidad en la atención en salud de la población, bajo condiciones de equidad, y dentro de sus componentes, se encuentran los requerimientos y procesos en el Sistema Integral de Información en Salud y Protección Social (Sispro), para integrar los componentes del modelo.
Que a su vez el documento Conpes 155 de 2012 desarrolla la “Política Farmacéutica Nacional”, especialmente la estrategia de “Diseño y puesta en operación de un Sistema Nacional de Información Farmacéutica (SNIF), sobre acceso, uso, calidad y precios”, incluido “el diseño de un plan de mejoramiento del Sismed que incluya la codificación única de medicamentos, que facilite la comparación de precios”.
Que, de otro lado, la estandarización de la identificación y clasificación de los medicamentos para uso humano, constituye una herramienta que facilita tanto el uso clínico como la gestión de la cadena logística, la cual comprende las etapas de fabricación, importación, comercialización, distribución, uso y disposición final de estos y las actividades de inspección, vigilancia y control de dichos productos, posibilitando la interoperabilidad en los procesos por lo que se hace necesario la actualización de los lineamientos técnicos para la definición e implementación del estándar de datos de los medicamentos de uso humano en Colombia.
Que la Dirección de Medicamentos y Tecnologías en Salud evidenció que el procedimiento para asignar el Identificador Único de Medicamentos (IUM) puede optimizarse a través del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima), ya que cuenta con una estructura organizacional y tecnológica robusta y dado su carácter de Autoridad Sanitaria Nacional, de reconocimiento y de referencia regional, así como en su condición de máxima autoridad de inspección, vigilancia y control sanitario.
Que la solicitud del código IUM se realiza previa a la presentación de la petición de las autorizaciones de importación de medicamentos vitales no disponibles, del registro sanitario de medicamentos y de la autorización de los medicamentos para el Programa Ampliado (PAI), así como de aquellos importados por entidades públicas, a través de Organización Panamericana de Salud, razón por la cual, en aras de la optimización de trámites y para facilitar a los usuarios la obtención del código, es pertinente que el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) realice la operación de la verificación y asignación de dicho código.
En mérito de lo expuesto,
RESUELVE:
DISPOSICIONES GENERALES.
ARTÍCULO 1o. OBJETO. La presente resolución tiene por objeto implementar el estándar de datos para los medicamentos de uso humano en Colombia.
ARTÍCULO 2o. ÁMBITO DE APLICACIÓN. Las disposiciones contenidas en la presente resolución aplican a los medicamentos de uso humano y son de obligatorio cumplimiento por los siguientes actores y agentes:
2.1 Titulares o importadores autorizados en el registro sanitario de medicamentos para uso humano.
2.2 Importadores de medicamentos vitales no disponibles.
2.3 Importadores de medicamentos para el Programa Ampliado de Inmunizaciones (PAI), para el control de vectores y de enfermedades de interés en salud pública y de medicamentos para el manejo de los esquemas básicos de las enfermedades transmisibles y de control especial.
2.4. Entidades públicas que importen medicamentos en salud pública a través de la Organización Panamericana de la Salud (OPS).
2.5. Personas naturales o jurídicas que ejercen actividades relacionadas con fabricación, importación, compra y venta, distribución, prescripción y uso de medicamentos para uso humano.
2.6. Entidades Administradoras de Planes de Beneficios (EAPB), incluidas las entidades que administren regímenes especiales y de excepción en salud, y las que administren planes adicionales de salud.
2.7. Instituciones Prestadoras de Servicios de Salud.
2.8. Entidades del nivel territorial que realicen pagos por atención en salud, en cualquier modalidad de atención y contratación.
2.9. Entidades adscritas y vinculadas al Sector Administrativo de Salud y Protección Social que en su operación manejen medicamentos y que realicen pagos por atención en salud, en cualquier modalidad de atención y contratación.
PARÁGRAFO. Se exceptúa de la aplicación de la presente resolución, los medicamentos homeopáticos y los productos fitoterapéuticos.
ARTÍCULO 3o. DEFINICIONES. Para efectos de la aplicación de la presente resolución se tendrán en cuenta las siguientes definiciones:
3.1. Estándar de datos de medicamentos: conjunto de atributos o características que permiten de manera unívoca la identificación, descripción, significado y relación de los datos utilizados para el intercambio de información de medicamentos, así como su normalización y actualización.
3.2. Atributos del estándar de datos de medicamentos: características, cualidades o propiedades del medicamento en cuanto a su descripción común, venta o comercialización.
3.3. Denominación Común Internacional (DCI): nombre recomendado por la Organización Mundial de la Salud (OMS) para cada medicamento, cuya finalidad es conseguir una buena identificación para cada fármaco, en el ámbito internacional.
3.4. Medicamento vital no disponible: medicamento indispensable e irremplazable para salvaguardar la vida o aliviar el sufrimiento de un paciente o un grupo de pacientes y que, por condiciones de baja rentabilidad en su comercialización, no se encuentra disponible en el país o las cantidades no son suficientes.
3.5. Norma Farmacológica Nacional: conjunto de condiciones y restricciones que establece y actualiza la Comisión Revisora del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima), como requisito para considerar el uso terapéutico de un fármaco y de sus asociaciones permitidas en el país como seguro, eficaz y acorde con un balance riesgo/beneficio favorable en circunstancias de empleo racional.
3.6. Unidad de Contenido: es la entidad en la cual se encuentra contenido el principio activo y que no necesariamente coincide con la forma farmacéutica.
ESTRUCTURA DEL ESTÁNDAR DE DATOS DE MEDICAMENTOS DE USO HUMANO.
ARTÍCULO 4o. FINALIDAD Y OBJETIVOS DE LA ESTANDARIZACIÓN DE DATOS DE MEDICAMENTOS DE USO HUMANO. La finalidad de la estandarización de los datos de medicamentos de uso humano es contribuir al desarrollo de la Política Farmacéutica Nacional y facilitar la interoperabilidad entre los agentes, en materia de medicamentos.
Los objetivos específicos de la estandarización de datos de medicamentos de uso humano son, entre otros, los siguientes:
4.1. Servir como insumo para la planeación, dirección, organización y control de las estrategias y actividades contenidas en la Política Farmacéutica Nacional.
4.2. Mejorar la gestión relacionada con el uso adecuado de los medicamentos y el gasto de los medicamentos, conforme a lo establecido en la normativa vigente.
4.3. Facilitar los procesos de regulación y vigilancia de precios de medicamentos, conforme a lo establecido en la normativa vigente.
4.4. Facilitar los procesos logísticos relacionados con medicamentos: Gestión de la demanda, aprovisionamiento, almacenamiento, distribución y logística inversa.
4.5. Servir de herramienta para apoyar la trazabilidad de los medicamentos a lo largo de toda la cadena de producción y comercialización, incluida la prescripción, dispensación, uso y disposición final.
4.6. Facilitar el intercambio de información entre las autoridades competentes que ejercen actividades de inspección, vigilancia y control de medicamentos.
PARÁGRAFO. Toda la información del estándar de datos de medicamentos de uso humano es de carácter público y de interés en salud pública.
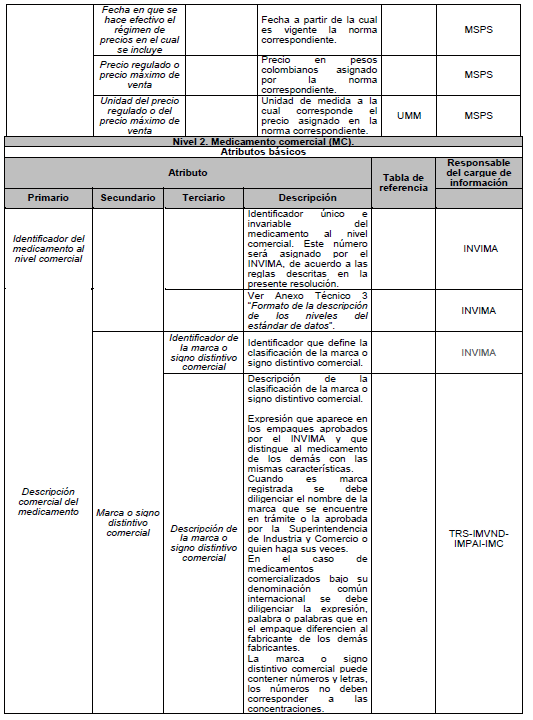
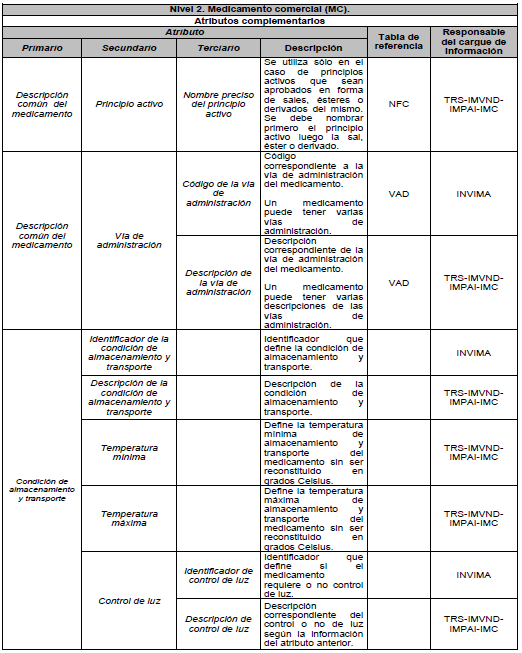
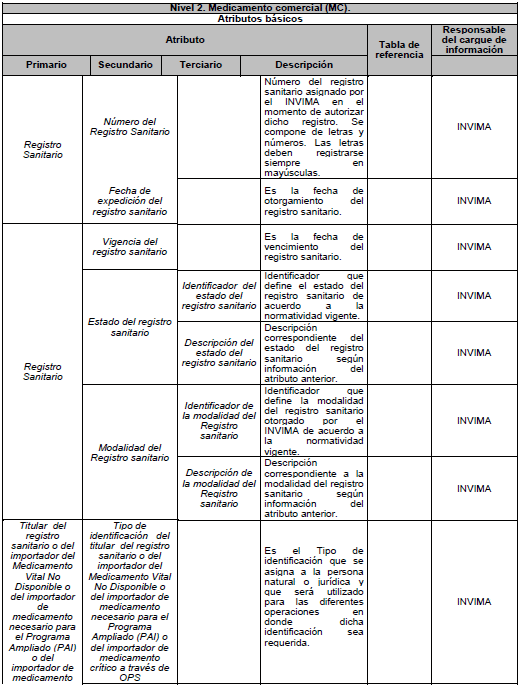
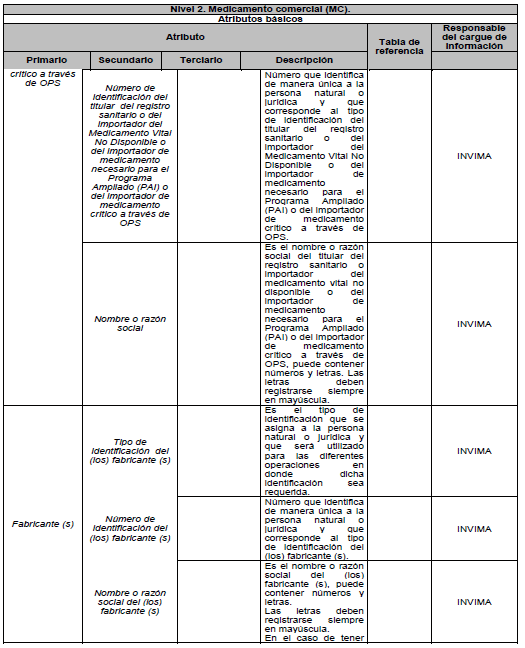
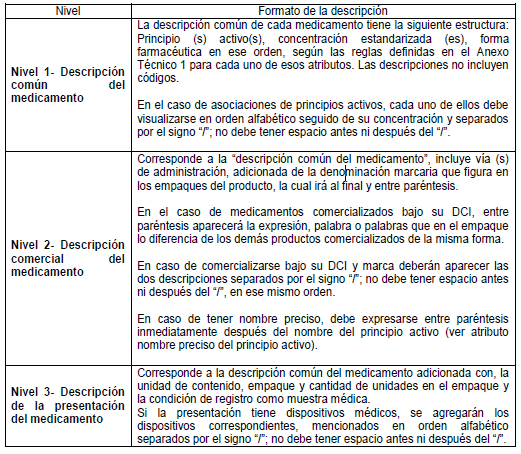
ARTÍCULO 5o. NIVELES DE DESCRIPCIÓN DEL MEDICAMENTO. Para efectos del estándar de datos, el medicamento se describe en tres niveles: Nivel 1. Medicamento en su descripción común; Nivel 2. Medicamento comercial y Nivel 3. Medicamento con presentación comercial, de acuerdo con el Anexo Técnico 3 “Formato de la Descripción de los niveles del estándar de datos” el cual hace parte integral de la presente resolución.
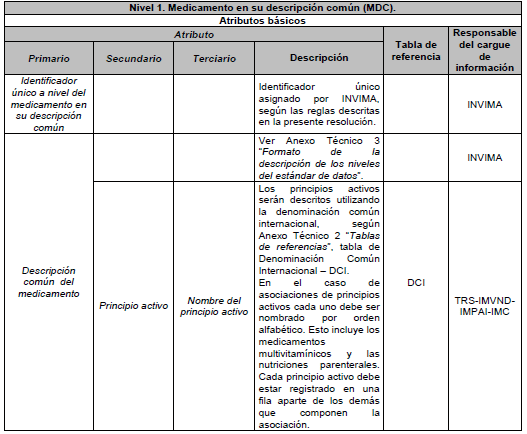
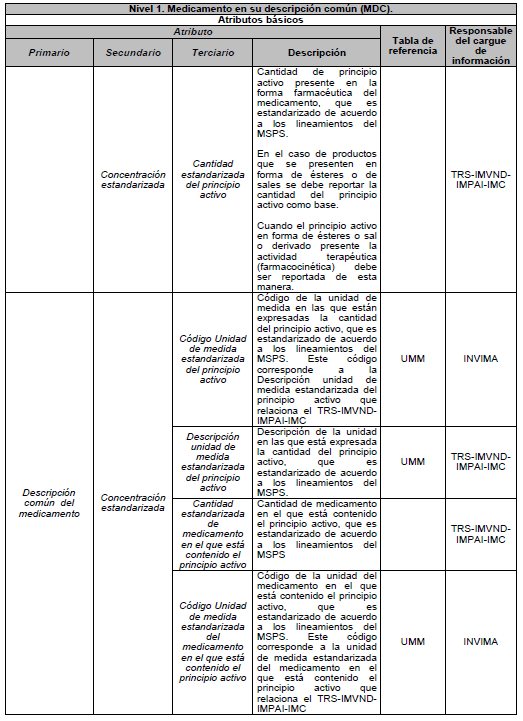
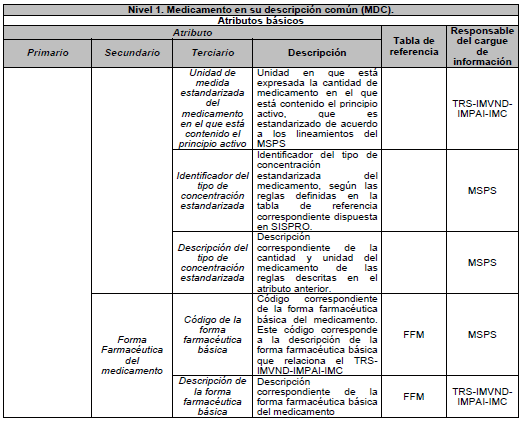
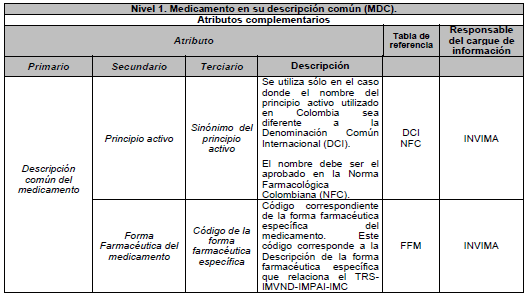
ARTÍCULO 6o. NIVEL 1. Medicamento en su descripción común (MDC). Es el medicamento en su Denominación Común Internacional (DCI), según las tablas de referencia adaptadas por el país y está compuesto por los siguientes atributos básicos:
6.1. Principio activo
6.2. Forma farmacéutica
6.3 Concentración
ARTÍCULO 7o. NIVEL 2. Medicamento comercial (MCO). Es el medicamento en su descripción común, con un distintivo que puede ser una marca comercial, una palabra que identifique al titular de registro sanitario o signo distintivo comercial definido. Los medicamentos con marca deben emplearla como distintivo. Los medicamentos comercializados bajo su DCI deben emplear el identificador del titular o importador de registro sanitario preferiblemente con el texto que aparece en el empaque del medicamento o el signo distintivo. Los medicamentos vitales no disponibles comercializados bajo su DCI deben emplear el nombre que identifica al fabricante o el signo distintivo.
ARTÍCULO 8o. NIVEL 3. Presentación del Medicamento. (MPC). Es un medicamento comercial (MCO) en una unidad de contenido y en una presentación específica. La unidad de contenido hace referencia a la entidad física en donde está contenida la dosis del medicamento. La presentación hace referencia al número de unidades de contenido en un mismo empaque.
ARTÍCULO 9o. ATRIBUTOS DEL ESTÁNDAR DE DATOS DE MEDICAMENTOS DE USO HUMANO. Cada nivel de descripción del medicamento a que hace referencia el artículo 5o de la presente resolución, tiene dos tipos de atributos:
9.1. Atributos básicos: son aquellos que describen de manera única al medicamento, en cada uno de los 3 niveles. Cualquier cambio en estos atributos originará un nuevo Identificador Único de Medicamento (IUM).
9.2. Atributos complementarios: son aquellos para los cuales un cambio en su valor no origina un nuevo Identificador Único de Medicamento (IUM).
Este Ministerio, el Invima, los titulares o importadores autorizados en el registro sanitario e importadores de medicamentos vitales no disponibles, importadores de medicamentos necesarios para el Programa Ampliado de Inmunizaciones (PAI) e importadores de medicamentos críticos a través de OPS son los responsables, según su competencia, de realizar los cambios a los atributos de acuerdo a lo señalado en el Anexo Técnico 1
PARÁGRAFO. Los atributos del estándar de datos de medicamentos de uso humano se establecen en el Anexo Técnico 1 “Descripción de atributos del estándar de datos de medicamentos” que hace parte integral de la presente resolución.
ARTÍCULO 10. COMPONENTES DEL ESTÁNDAR DE DATOS DE MEDICAMENTOS DE USO HUMANO. El estándar de datos de medicamentos de uso humano está constituido por:
10.1. Identificador Único de Medicamento (IUM): cada medicamento tendrá asignado un identificador que permitirá diferenciar cada uno de los tres niveles de descripción y será asignado por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima). Las características del identificador son:
10.1.1. Único: cada presentación de un medicamento se reconoce con un solo IUM, es decir la suma de los tres niveles no identifica ningún otro producto.
10.1.2. Invariable: el identificador no cambiará con el tiempo ni deberá ser utilizado en otros medicamentos una vez sea asignado a un producto con registro sanitario, a un medicamento vital no disponible, los necesarios para el Programa Ampliado de Inmunizaciones (PAI) o los importados por entidades públicas a través de Organización Panamericana de la Salud (OPS)
10.1.3. Sin propietario: el Identificador Único de Medicamentos es de uso público.
10.1.4. Con estado: activo, inactivo o cancelado.
10.2 Descripciones estandarizadas: Es la forma en que deben ser descritos los diferentes atributos del medicamento.
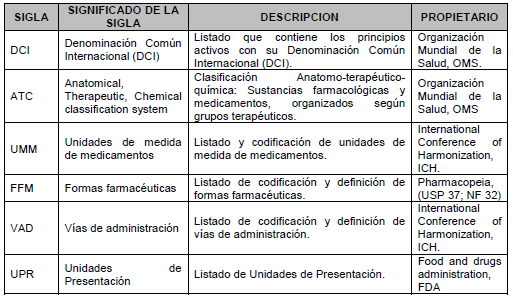
10.3. Tablas de referencia: Listados que deben ser utilizados para conocer el identificador y la descripción de aquellos atributos del estándar de datos de medicamentos que se encuentran definidos y son generados por autoridades y organizaciones nacionales e internacionales. La actualización de las Tablas de Referencia será realizada por el Invima, en coordinación con este Ministerio.
ARTÍCULO 11. ASIGNACIÓN DEL IDENTIFICADOR ÚNICO DEL MEDICAMENTO (IUM). El Identificador Único del Medicamento será asignado por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) y permitirá relacionar el medicamento en su descripción común (MDC), con el medicamento comercial (MCO) y la presentación comercial (MPC).
Tendrá los caracteres que sean definidos por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima), y en todo caso se escribirán sin puntos, guiones, tildes, ni espacios.
Para la asignación del Identificador Único del Medicamento (UM), se debe tener en cuenta lo siguiente:
11.1. Medicamento en su descripción común (MDC). Cada medicamento en su descripción común tendrá un número identificador.
11.2. Medicamento comercial (MCO). Las alternativas comerciales que existan para un mismo medicamento, tendrán el mismo código del medicamento en su descripción común adicionando un consecutivo que define la marca comercial o signo distintivo de cada una de las alternativas comerciales.
11.3. Presentación del Medicamento (MPC). Cada presentación de un medicamento tiene un identificador que debe ir unido al identificador del medicamento comercial.
PARÁGRAFO 1o. En las etiquetas y los empaques de los medicamentos no se requiere la impresión del Identificador Único del Medicamento (IUM).
PARÁGRAFO 2o. El Invima publicará la información de los registros sanitarios, renovaciones o modificaciones de los mismos, o de autorizaciones para importar medicamentos, cumpliendo con los parámetros definidos en los Anexos que hacen parte integral de la presente resolución.
ARTÍCULO 12. ADOPCIÓN DE LAS TABLAS DE REFERENCIA. Adóptese las tablas de referencia contenidas en el Anexo Técnico 2 “Tablas de referencia”, que hacen parte integral de la presente resolución y que serán de uso obligatorio por parte de los destinatarios a que alude el artículo 2o de este acto.
Las tablas de referencia serán actualizadas por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima), en coordinación con el Ministerio de Salud y Protección Social cuando exista la necesidad de adicionar o inactivar parámetros. Estarán dispuestas de manera permanente en la página web de ese Instituto e integradas al Sistema Integral de Información en Salud y Protección Social (Sispro).
ARTÍCULO 13. USO OBLIGATORIO DEL IDENTIFICADOR ÚNICO DEL MEDICAMENTO. Todo medicamento que se comercialice o se utilice en el territorio nacional, deberá contar con el Identificador Único de Medicamento (IUM).
Los interesados que soliciten registro sanitario de medicamentos, su renovación, modificación, o la autorización de importación de medicamentos vitales no disponibles, los medicamentos necesarios para el Programa Ampliado de Inmunizaciones (PAI), los medicamentos importados por entidades públicas a través de Organización Panamericana de la Salud (OPS), y los destinatarios a que alude el artículo 2o de la presente resolución, deben utilizar el Identificador Único del Medicamento (IUM) asignado por el Invima, una vez se ha finalizado el trámite respectivo.
RESPONSABILIDADES DE LAS ENTIDADES EN EL USO E IMPLEMENTACIÓN DEL ESTÁNDAR DE DATOS PARA MEDICAMENTOS.
ARTÍCULO 14. RESPONSABILIDADES DE LOS TITULARES O IMPORTADORES AUTORIZADOS EN EL REGISTRO SANITARIO E IMPORTADORES DE MEDICAMENTOS VITALES NO DISPONIBLES, IMPORTADORES DE MEDICAMENTOS NECESARIOS PARA EL PROGRAMA AMPLIADO DE INMUNIZACIONES (PAI) O IMPORTADORES DE MEDICAMENTOS CRÍTICOS A TRAVÉS DE OPS. Los titulares o importadores autorizados en el registro sanitario e importadores de medicamentos vitales no disponibles o importadores de medicamentos necesarios para el Programa Ampliado de Inmunizaciones (PAI) o importadores de medicamentos críticos a través de la Organización Panamericana de la Salud (OPS) serán responsables de:
14.1. Utilizar el estándar de datos de medicamentos, el Identificador Único del Medicamento (IUM) y las Tablas de Referencia especificadas para cada uno de los atributos de los medicamentos.
14.2. Reportar la información del estándar de datos según lo establecido en la presente resolución.
14.3. Informar los casos que requieran actualización de las tablas de referencia para algún caso específico. En este evento, deben solicitar al Invima, la actualización debidamente justificada.
14.4. Informar al Invima cuando se detecten inconsistencias en la información del estándar de datos de medicamentos.
14.5. Garantizar la veracidad de la información reportada al Invima.
ARTÍCULO 15. RESPONSABILIDADES DE LOS INTEGRANTES DEL SISTEMA GENERAL DE SEGURIDAD SOCIAL EN SALUD Y DE LAS ENTIDADES QUE ADMINISTREN LOS REGÍMENES ESPECIAL Y DE EXCEPCIÓN. Los integrantes del Sistema General de Seguridad Social en Salud y las entidades que administren los regímenes Especial y de Excepción, serán responsables de:
15.1. <Rige a partir del 1 de julio de 2022> Utilizar el estándar de datos de medicamentos de uso humano para realizar los procesos que impliquen identificación y denominación de los medicamentos, en toda la cadena logística y en todos los usos institucionales.
15.2. Informar al Invima las inconsistencias que se detecten en la información del estándar de datos de medicamentos.
15.3 Los prescriptores deberán utilizar la tabla de referencia de DCI de acuerdo a lo establecido en el artículo 2.5.3.10.16 del Decreto 780 de 2015 <sic> y la concentración para prescripción.
ARTÍCULO 16. RESPONSABILIDADES DE LOS QUE INTERVIENEN EN LAS CADENAS DE PRODUCCIÓN, DISTRIBUCIÓN, COMERCIALIZACIÓN Y OTRAS FORMAS DE INTERMEDIACIÓN DE MEDICAMENTOS. Los agentes y actores de las cadenas de producción, distribución, comercialización y otras formas de intermediación de medicamentos, serán responsables de:
16.1. <Rige a partir del 1 de julio de 2022> Utilizar el estándar de datos de medicamentos de uso humano para realizar los procesos que impliquen identificación y denominación de los medicamentos, en toda la cadena logística y en todos los usos institucionales.
16.2. Informar al Invima las inconsistencias que se detecten en la información del estándar de datos de medicamentos.
REPORTE DE INFORMACIÓN DEL ESTÁNDAR DE DATOS DE MEDICAMENTOS Y CARGUE DE DATOS AL SISTEMA INTEGRADO DE INFORMACIÓN DE LA PROTECCIÓN SOCIAL (SISPRO).
ARTÍCULO 17. REPORTE DE INFORMACIÓN DEL ESTÁNDAR DE DATOS DE MEDICAMENTOS. A partir de la entrada en vigencia de la presente resolución, los titulares o importadores autorizados en el registro sanitario e importadores de medicamentos vitales no disponibles, importadores de medicamentos necesarios para el Programa Ampliado de Inmunizaciones (PAI) o importadores de medicamentos críticos a través de OPS deberán reportar la información del estándar de datos de medicamentos de uso humano, en la solicitud de registro sanitario, renovación o modificación o autorización de importación de medicamentos vitales no disponibles o autorización de importación de medicamentos críticos a través de la OPS y los adquiridos con destino al PAI, de acuerdo con lo dispuesto en la presente resolución, y en el instructivo que para el efecto expida el Invima en su página web, para lo cual contará con un plazo de dos (2) meses, contado a partir de la publicación de este acto.
ARTÍCULO 18. RESPONSABILIDAD DEL CARGUE DEL ESTÁNDAR DE DATOS DE MEDICAMENTOS. Son responsables del cargue directamente al Sistema de Información de la Protección Social (Sispro), de los atributos que se establecen en el Anexo Técnico 1. “Descripción de atributos del Estándar de Datos de Medicamentos”, los siguientes:
18.1. Quienes soliciten por primera vez el registro sanitario.
18.2. Quienes renueven el registro sanitario.
18.3. Quienes modifiquen el registro sanitario en alguno de los aspectos del IUM.
18.4. Quienes soliciten la autorización de importación de medicamentos vitales no disponibles.
18.5. Quienes realicen importación de medicamentos necesarios para el Programa Ampliado de Inmunizaciones (PAI), para el control de vectores y de enfermedades de interés en salud pública y de medicamentos para el manejo de los esquemas básicos de las enfermedades transmisibles y de control especial.
18.6. Quienes importen medicamentos en salud pública a través de la Organización Panamericana de la Salud (OPS).
Los datos de aquellos atributos de los cuales la fuente primaria no proviene del responsable del cargue de datos, deben ser actualizados por las entidades señaladas en el Anexo Técnico 1 “Descripción de atributos del Estándar de Datos de Medicamentos”.
PARÁGRAFO. Toda modificación o actualización de la información inicialmente reportada debe ser presentada ante el Invima por parte de los responsables del cargue de la misma.
ARTÍCULO 19. REVISIÓN Y VERIFICACIÓN DE LOS ATRIBUTOS DEL ESTÁNDAR DE DATOS DE MEDICAMENTOS. El Invima revisará y verificará la información del estándar de datos de medicamentos de uso humano, para lo cual debe tener en cuenta que la información suministrada a la plataforma del Sistema Integral de Información de la Protección Social (Sispro) por los interesados concuerde con los requerimientos del registro sanitario o de autorización de importación de medicamentos, cuando sea el caso.
ARTÍCULO 20. INCUMPLIMIENTO EN EL REPORTE DEL ESTÁNDAR DE DATOS DE MEDICAMENTOS DE USO HUMANO. La inobservancia de las disposiciones sobre reporte de información del Estándar de Datos de Medicamentos de uso humano por parte de los obligados a ello, constituye una infracción a lo establecido en el artículo 114 de la Ley 1438 de 2011 y dará lugar a las sanciones descritas en los artículos 116 y 132 ibídem, por parte de los órganos y entes de control respectivos.
PARÁGRAFO. Este Ministerio pondrá a disposición de los órganos que ejerzan actividades de inspección, vigilancia y control, la información cuando estas lo requieran.
ARTÍCULO 21. SEGURIDAD DE LA INFORMACIÓN. Se garantizará la disponibilidad, integridad y no repudio de la información reportada con el fin de preservar su seguridad y veracidad.
ARTÍCULO 22. VIGENCIA Y DEROGATORIAS. <Artículo modificado por el artículo 1 de la Resolución 1113 de 2020. El nuevo texto es el siguiente:> La presente resolución rige a partir de la fecha de su publicación, salvo los numerales 15.1 del artículo 15 y 16.1 del artículo 16, los cuales regirán a partir del 1 de julio de 2022.
Publíquese y cúmplase.
Dada en Bogotá, D. C., a 3 de agosto de 2018.
El Ministro de Salud y Protección Social,
Alejandro Gaviria Uribe.
DESCRIPCIÓN DE ATRIBUTOS DEL ESTÁNDAR DE DATOS DE MEDICAMENTOS.
Siglas Utilizadas:
- MSPS: Ministerio de Salud y Protección Social
- INVIMA: Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA.
- TRS-IMVND-IMPAI-IMC: Titulares o importadores autorizados en el registro sanitario de medicamentos necesarios para uso humano o importador de medicamento vital no disponible o medicamentos necesarios para el programa ampliado (PAI) o importadores de medicamentos críticos a través de OPS.
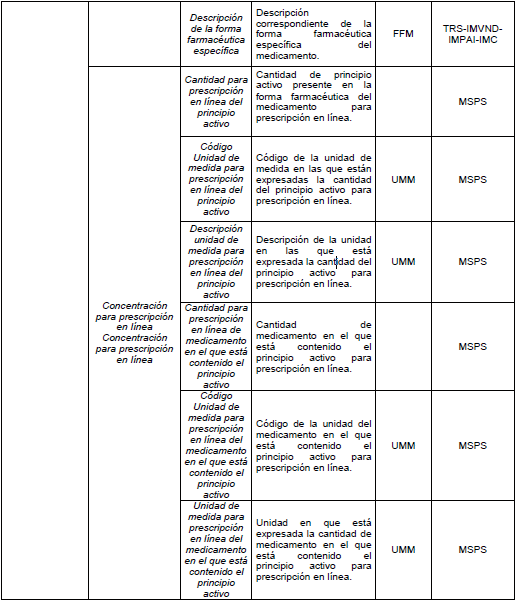
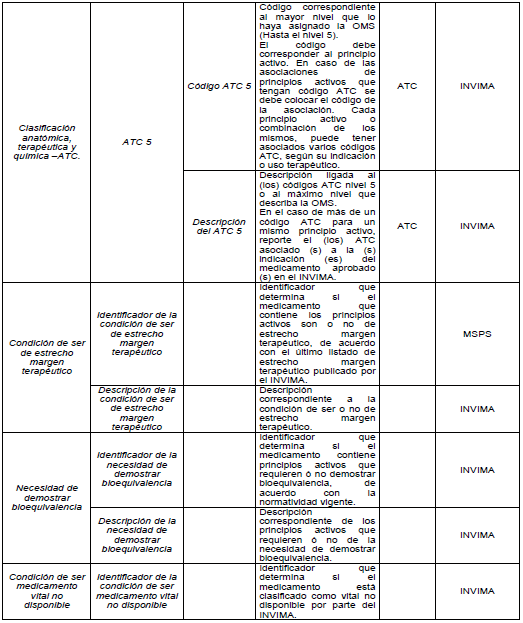
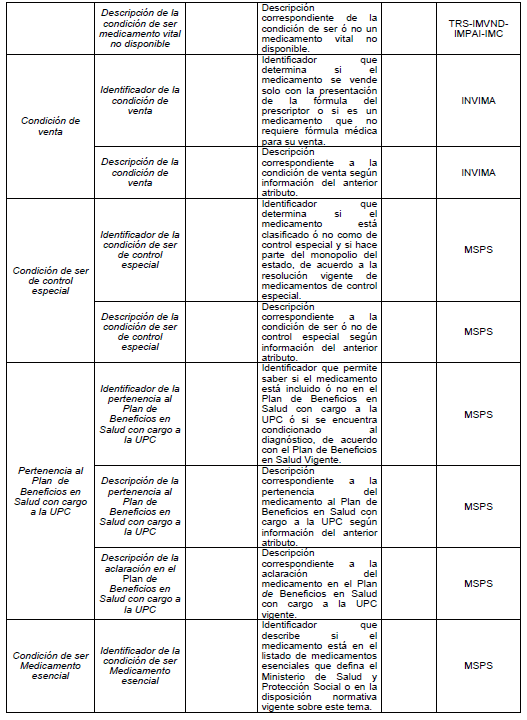
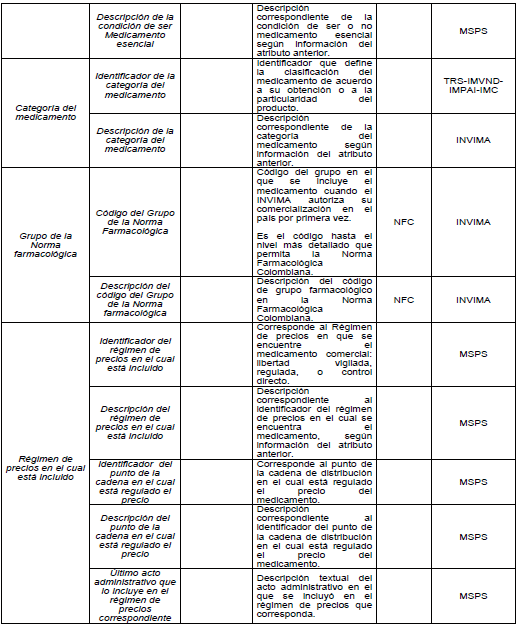
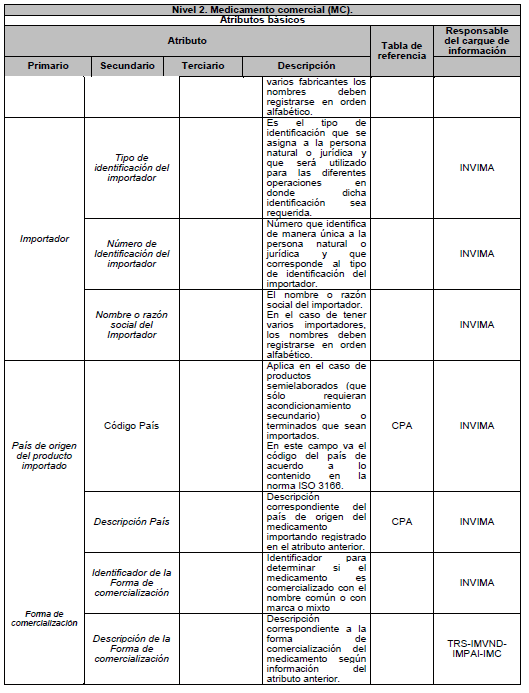
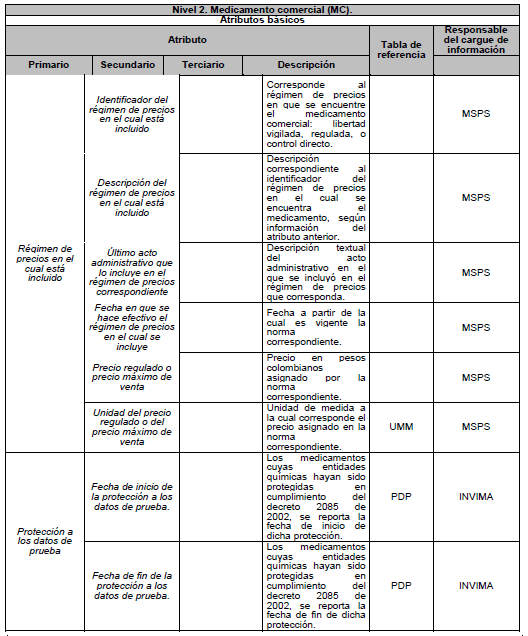
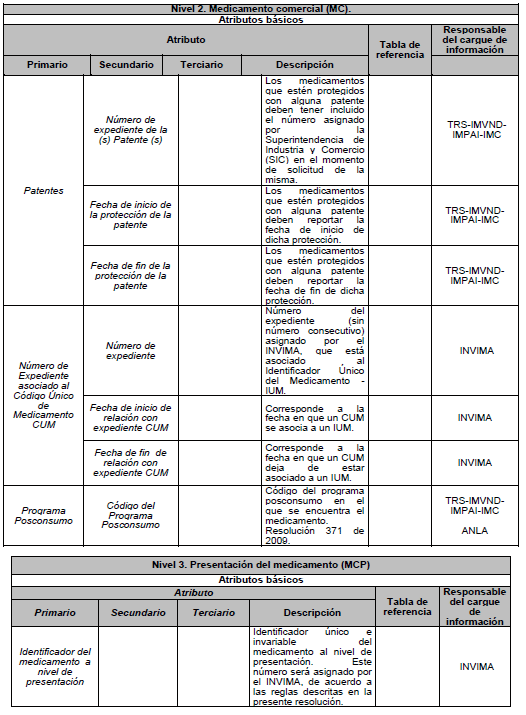
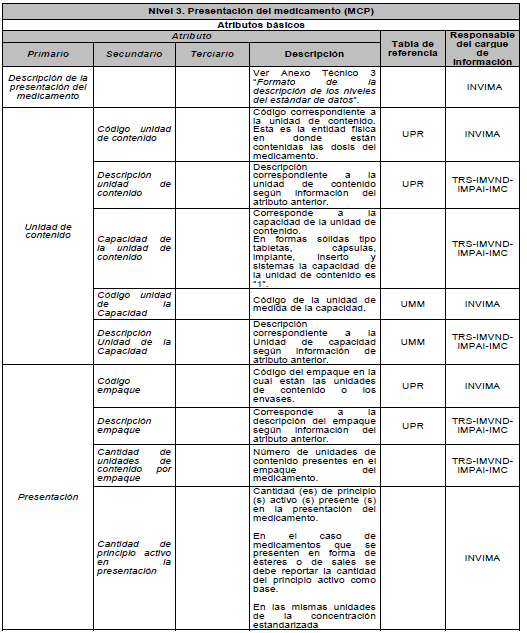
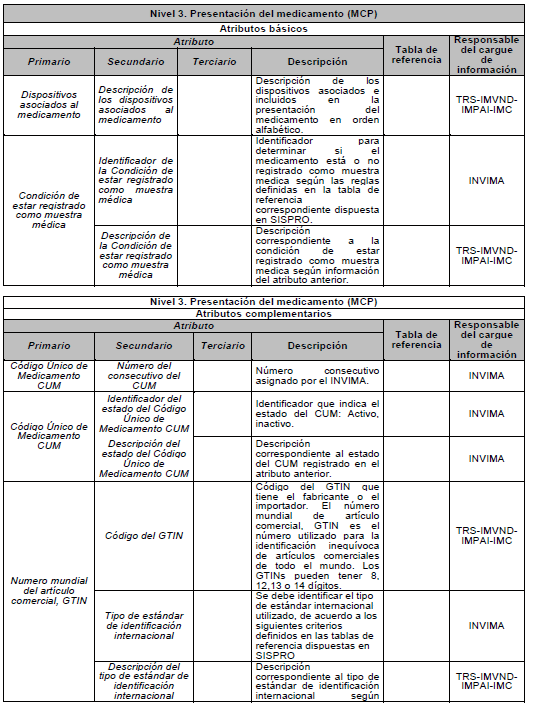
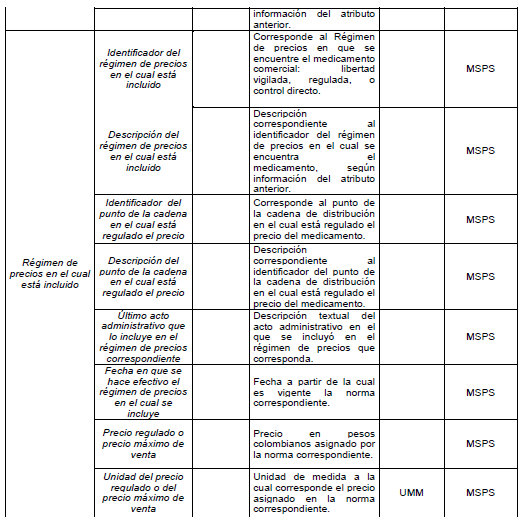
TABLAS DE REFERENCIA.
Codificaciones comunes nacionales disponibles en www.minsalud.gov.co
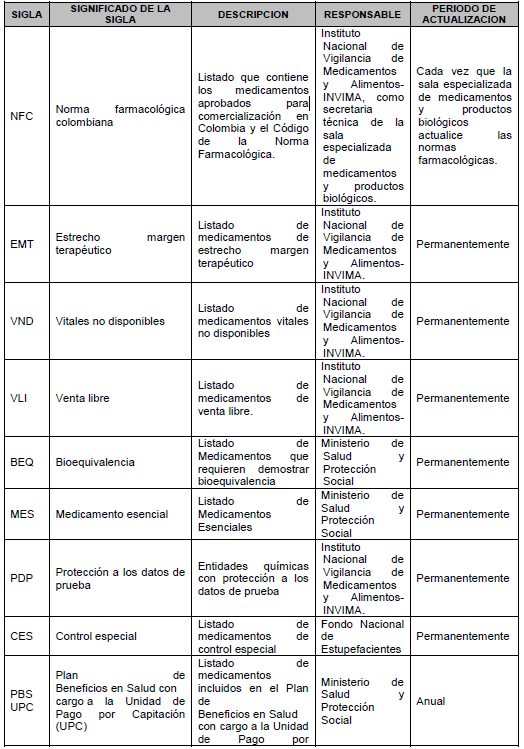

Codificaciones comunes internacionales adaptadas, disponibles en www.misalud.gov.co.
FORMATO DE LA DESCRIPCIÓN DE LOS NIVELES DEL ESTÁNDAR DE DATOS.
Para los efectos de uso del estándar establecido en el Capítulo IV, la descripción de los medicamentos en cada uno de sus niveles, debe realizarse de acuerdo al siguiente formato.
Las notas de vigencia, concordancias, notas del editor, forma de presentación y disposición de la compilación están protegidas por las normas sobre derecho de autor. En relación con estos valores jurídicos agregados, se encuentra prohibido por la normativa vigente su aprovechamiento en publicaciones similares y con fines comerciales, incluidas -pero no únicamente- la copia, adaptación, transformación, reproducción, utilización y divulgación masiva, así como todo otro uso prohibido expresamente por la normativa sobre derechos de autor, que sea contrario a la normativa sobre promoción de la competencia o que requiera autorización expresa y escrita de los autores y/o de los titulares de los derechos de autor. En caso de duda o solicitud de autorización puede comunicarse al teléfono 617-0729 en Bogotá, extensión 101. El ingreso a la página supone la aceptación sobre las normas de uso de la información aquí contenida.