



RESOLUCIÓN 1579 DE 2023
(octubre 2)
Diario Oficial No. 52.536 de 2 de octubre de 2023
MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL
Por medio de la cual se declara la existencia de razones de interés público para someter una patente de los medicamentos cuyo principio activo es el Dolutegravir a licencia obligatoria en la modalidad de uso gubernamental.
EL MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL,
en ejercicio de sus atribuciones legales y reglamentarias, en especial las conferidas por el Decreto Ley 4107 de 2011 y el Capítulo 24 del Decreto 1074 de 2015 Único Reglamentario del Sector Comercio, Industria y Turismo, modificado por el Decreto 670 de 2017, y
CONSIDERANDO:
1. ANTECEDENTES
1.1. Normativos
Que el artículo 2o de la Constitución Política de Colombia prevé que uno de los fines esenciales del Estado es “servir a la comunidad”, así como la observancia de los “deberes sociales del Estado”, cuyo cumplimiento corresponde asegurar a las autoridades de la República.
Que en concordancia con el artículo 49 de la Constitución Política de Colombia “(...) la atención de la salud y el saneamiento ambiental son servicios públicos a cargo del Estado”, por lo cual, este tiene el deber de garantizar “(…) a todas las personas el acceso a los servicios de promoción, protección y recuperación de la salud” y por ende, le asiste al Estado dirigir la prestación de servicios de salud “(...) conforme a los principios de eficiencia, universalidad y solidaridad”.
Que el artículo 366 constitucional instituye como “finalidades sociales del Estado” el bienestar general y el mejoramiento de la calidad de vida de la población, y que, de igual manera, es objetivo fundamental de su actividad, la solución de las necesidades insatisfechas de salud, de educación, de saneamiento ambiental y de agua potable.
Que el artículo 2o y el literal k) del artículo 6o de la Ley Estatutaria 1751 de 2015 establecen que “[e]l derecho fundamental a la salud es autónomo e irrenunciable en lo individual y en lo colectivo”, y que “[e]l sistema de salud debe procurar por la mejor utilización social y económica de los recursos, servicios y tecnologías disponibles para garantizar el derecho a la salud de toda la población”.
Que los recursos con los cuales se cubren los medicamentos incluidos en el Plan de Beneficios en Salud (PBS) son de carácter público; en consecuencia, los costos de los medicamentos que son pagados a partir de estos dineros son de especial relevancia pública.
Que por los motivos anteriores, se debe propender por generar mayores eficiencias en el sistema de salud con miras a garantizar el pleno disfrute y acceso de la población colombiana al derecho fundamental a la salud, lo que constituye un interés público que debe perseguir el Estado colombiano.
Que aunado a lo anterior, el artículo 65 de la Decisión Andina 486 de 2000 establece que “previa declaratoria de un País Miembro de la existencia de razones de interés público (…) se podrá someter la patente a licencia obligatoria. En tal caso, la oficina nacional competente otorgará las licencias que se soliciten. El titular de la patente objeto de la licencia será notificado cuando sea razonablemente posible”.
Que la Decisión Andina fue reglamentada por el Decreto 4302 de 2008, compilado en el Decreto 1074 de 2015 Único Reglamentario del Sector Comercio, Industria y Turismo, en el que se reguló la competencia y el procedimiento para la declaratoria de existencia de razones de interés público con el propósito de otorgar licencias obligatorias sobre productos o procedimientos objeto de patente.
Que el parágrafo 2 del artículo 2.2.2.24.4 del Decreto 1074 de 2015 otorgó la facultad a la autoridad competente para iniciar de oficio el procedimiento administrativo para la declaratoria de existencia de razones de interés público con el propósito de otorgar licencias obligatorias.
1.2. Procedimentales
Que, con ocasión a la facultad conferida en el parágrafo 2 del artículo 2.2.2.24.4 del Decreto 1074 de 2015, este Ministerio profirió la Resolución número 881 del 2 de junio de 2023, por la cual se dio inicio al procedimiento administrativo de declaratoria de existencia de razones de interés público para someter las patentes de los medicamentos cuyo principio activo es el Dolutegravir a licencia obligatoria.
Que la Resolución número 881 de 2023 fue publicada en el Diario Oficial número 52.417 del 5 de junio de 2023, así como en el sitio web del Ministerio de Salud y Protección Social.
Que el mencionado acto administrativo otorgó el término de diez (10) días hábiles, contados a partir del día siguiente a su publicación en el Diario Oficial, para que los titulares de las patentes, del registro sanitario y los terceros determinados e indeterminados se pronunciaran frente al mismo en los términos del artículo 38 de la Ley 1437 de 2011.
Que con ocasión a la posibilidad de presentar observaciones al inicio de la actuación administrativa, los siguientes interesados presentaron sus intervenciones y pronunciamientos:
| No. | TERCERO INTERESADO |
| 1 | Aurobindo |
| 2 | Blanver farmoquímica e farmacéutica |
| 3 | Andrea Boccardi Vidarte - ONUSIDA para los países andinos |
| 4 | José Alberto León - Fundación Bases |
| 5 | AHF Colombia |
| 6 | Oswaldo Adolfo Rada |
| 7 | Federación Latinoamericana de la Industria Farmacéutica Fifarma |
| 8 | Global Humanitarian Progress Corporation |
| 9 | Fundación Ancla - La Organización Pacientes Colombia, la Asociación Colombia Saludable y El Mecanismo De Apoyo Control en Vih de Colombia - MSACVCO |
| 10 | Public Citizen y otras 111 organizaciones civiles |
| 11 | Germán Velásquez - South Centre |
| 12 | Instituto de Ciencia Política Hernán Echavarría Olózaga - ICP |
| 13 | Innos Instituto de Prospectiva e Innovación en Salud - |
| 14 | CEA (consejo de empresas americanas) Colombia - Ricardo Triana |
| 15 | María Clara Escobar Peláez - AFIDRO (Asociación de laboratorios farmacéuticos de investigación y desarrollo) |
| 16 | Property Rights Alliance |
| 17 | Luis Ángel Madrid - Universidad Sergio Arboleda |
| 18 | Asociación de Industrias Farmacéuticas en Colombia - Asinfar- |
| 19 | Pablo Felipe Robledo |
| 20 | Misión Salud 14 - Comité de Veeduría y Cooperación en Salud (CVCS) |
| 21 | Carlos Olarte - Rivanima Therapeutics DE Corp. |
| 22 | Viiv Healthcare Company Shionogi & CO - Glaxosmithkline Colombia S. A. |
| 23 | Reyes y Reyes Abogados |
| 24 | Asociación Colombiana de Propiedad Intelectual |
| 25 | Organización Panamericana de la Salud |
| 26 | Cámara de Comercio Colombo Americana Amcham Colombia |
| 27 | Jorge Pacheco - Liga Colombiana de Lucha contra el SIDA |
| 28 | Alfredo Corral Ponce - Profesor universitario. |
| 29 | Cámara de la Industria Farmacéutica de la ANDI |
| 30 | Asociación de Laboratorios Farmacéuticos de Investigación y Desarrollo |
Que entre las observaciones recibidas, la Asociación de Laboratorios Farmacéuticos de Investigación y Desarrollo (AFIDRO) solicitó al MSPS “(i) revoque la Resolución; (ii) declare que no hay razones de interés público que ameriten un proceso de licenciamiento obligatorio; y (iii) archive y dé por terminado el procedimiento ordenado por medio de la Resolución 881 del 2 de junio de 2023”.
Que la solicitud de revocatoria directa fue resuelta a través del Auto No. 1 del 17 de agosto de 2023, en el sentido de rechazar la solicitud por improcedente, argumentando que la Resolución número 881 del 2 de junio de 2023 no es susceptible de revocatoria por tratarse de un acto administrativo de trámite.
Que la citación para notificar personalmente el acto administrativo fue remitida a AFIDRO el 18 de agosto de 2023 y debido a que no se logró la notificación personal, se procedió a realizar la notificación por aviso, luego de lo cual fue enviada a través de correo electrónico el día 30 de agosto de 2023.
Que adicionalmente, en sus escritos de observaciones y pronunciamientos sobre el inicio del procedimiento de declaratoria de existencia de razones de interés público para someter las patentes de los medicamentos cuyo principio activo es el Dolutegravir a licencia obligatoria, la Asociación de Laboratorios Farmacéuticos de Investigación y Desarrollo (AFIDRO); ViiV Healthcare Company; Shionogi & Co Ltd.; Glaxosmithkline Colombia S. A. y el señor José Luis Reyes Villamizar realizaron unas solicitudes probatorias para adoptar la decisión de fondo dentro de la actuación administrativa.
Que en virtud del numeral 4 del artículo 2.2.2.24.4 del Decreto 1074 de 2015, las solicitudes probatorias se resolvieron a través del Auto No. 002 del 18 de agosto de 2023, notificado por aviso enviado a los correos electrónicos de los interesados el 30 de agosto de 2023 y publicado en la página web del Ministerio el mismo día.
Como consecuencia de lo anterior, se decretaron las siguientes pruebas documentales:
1. Pruebas aportadas por la Asociación de Laboratorios Farmacéuticos de Investigación y Desarrollo (AFIDRO):
| NOMBRE DE LOS ARTÍCULOS APORTADOS: | AÑO PUBLICACIÓN |
| Cuenta de Alto Costo. Situación del VIH en Colombia. | 2023 |
| Organización Mundial de la Salud. VIH y sida. | 2023 |
| Organización Panamericana de la Salud. Epidemia del VIH y respuesta en América Latina y el Caribe. | 2022 |
| ONUSIDA Actualización mundial sobre el Sida | 2022 |
| World Health Organization (WHO). Consolidated guidelines on HIV prevention, testing, treatment, service delivery and monitoring: recommendations for a public health approach. Julio, 2021. | 2021 |
| Tratado TLC Japón | 2011 |
| Acuerdo sobre los ADPIC | 1995 |
2. Pruebas aportadas por Viiv Healthcare Company, Shionogi & Co. LTD y Glaxosmithkline Colombia S. A.:
| NOMBRE DEL ARCHIVO | AÑO PUBLICACIÓN |
| Life expectancy after 2015 of adults with HIV on long-term antiretroviral therapy in Europe and North America: a collaborative, analysis of cohart studies | 2023 |
| Hoja informativa 2021. Estadísticas mundiales sobre el VIH | 2021 |
| Capítulo 4 de la publicación Estrategias mundiales del sector de la salud contra el VIH, las hepatitis víricas y las infecciones de transmisión sexual para el periodo 2022-2030 | 2022 |
| Licences de Medicines Patent Pool. | s.f. |
| Situación de VIH en Colombia 2022. Págs. 38, 49, 65, 72, 76, 115 y 130. | 2022 |
| Encuesta Bioconductual sobre el VIH, la Sífilis y el estado de salud de los venezolanos que viven en Colombia | 2022 |
| UNAIDS Data 2022 | 2022 |
| Informe de Evento VIH/SIDA. Periodo epidemiológico XIII Colombia 2022 | 2022 |
| Protocolo de vigilancia de VIH/SIDA | 2022 |
| Boletín epidemiológico Semanal #47 | 2022 |
| Extracto “Dolutegravir” de Update on progress of MPP sublicensees, Till de Medicines Patent Pool | 2022 |
| Improving Access to HIV Medicines | 2022 |
| Ser migrante y luchar contra el VIH: una carrera de obstáculos por la vida | 2023 |
| World Bank Country and Lending Groups | s.f. |
| VIH y SIDA | 2023 |
| Policy brief. Update of Recommendations on Frist and second line antiretroviral regimens. | 2019 |
| Guía de Práctica Clínica (GPC) basada en la evidencia científica para la atención de la infección por VIH/SIDA en personas adultas, gestantes y adolescentes 2021. Págs. 41, 42, 219, 221, 439, 441, 590, 591, 1505, 1507 y 1509. | 2021 |
| Sistema de trámites en línea - consultas públicas del INVIMA. Captura de pantalla. | N/A |
| Registro INVIMA 2021M-0020165 el Neovir (Raltegravir). | N/A |
| Lista de precios de acuerdos a largo plazo del Fondo Estratégico OPS. Pág. 7 | 2022 |
Que el 31 de agosto de 2023 la firma Cavelier Abogados, en representación de las sociedades VIIV HEALTHCARE COMPANY, SHIONOGI & CO., LTD y GLAXO SMITHK COLOMBIA S. A., se dio por notificado del auto que resolvió las pruebas y solicitó a esta cartera (i) aclarar las pruebas documentales efectivamente negadas, (ii) aclarar la exclusión de las intervenciones presentadas por la Cámara de Comercio Colombo Americana - AMCHAM y el señor Alfredo Corral Ponce, (iii) revocar el acto administrativo y (iv) decretar las pruebas solicitadas.
Que estas solicitudes fueron resueltas a través del Auto No. 003 del 15 de septiembre de 2023, notificado personalmente a través de correo electrónico enviado el 22 de septiembre de 2023.
1.3. De la conformación, instalación y decisión del Comité Técnico Interinstitucional
Que a través de la Resolución número 881 del 2 de junio de 2023 se creó el Comité Técnico Interinstitucional conformado por representantes del Ministerio de Salud y Protección Social, el Ministerio de Comercio, Industria y Turismo y del Departamento Nacional de Planeación, con el propósito de ejercer las funciones establecidas en el artículo 2.2.2.24.6 del Decreto 1074 de 2015.
Que por medio de la Resolución número 750 del 26 de junio de 2023, el Ministerio de Comercio, Industria y Turismo delegó la representación de ese Ministerio ante el Comité Técnico Interinstitucional, en el Viceministro de Comercio Exterior.
Que por su parte, en la Resolución número 1446 del 4 de julio de 2023, el Departamento Nacional de Planeación delegó al Director Técnico de la Dirección de Innovación y Desarrollo Empresarial del DNP como miembro integrante del Comité Técnico.
Que el Ministerio de Salud y Protección Social delegó a la Directora de Medicamentos y Tecnologías en Salud como representante de esta entidad ante el Comité, conforme quedó resuelto en la Resolución número 1097 del 7 de julio de 2023.
Que, hechas las anteriores delegaciones para la conformación del Comité, este sesionó válidamente los días 1 y 18 de agosto de 2023.
Que, como resultado de la evaluación de los documentos aportados por los terceros interesados en el marco del Comité Técnico Interinstitucional y de la información recopilada por este último, se recomendó al Ministerio de Salud y Protección Social declarar la existencia de razones de interés público para someter las patentes de los medicamentos cuyo principio activo es el Dolutegravir a licencia obligatoria en la modalidad de uso gubernamental.
Que las justificaciones de la recomendación “están enmarcadas en el análisis de la situación del VIH en Colombia, el comportamiento de la enfermedad y avances en la detección temprana, la información de acceso al tratamiento antirretroviral, análisis de costos y los aspectos legales del proceso (…)”.
Que el Comité Técnico Interinstitucional publicó las recomendaciones el 5 de septiembre de 2023 por un término de diez (10) días, contados desde el 6 de septiembre de 2023 hasta el 19 de septiembre de 2023.
Que se recibieron las siguientes observaciones al informe de recomendaciones:
| No. | TERCERO INTERESADO/ENTIDAD PÚBLICA |
| 1 | Daniel Hernández, médico especialista en medicina familiar y experto en VIH |
| 2 | Asociación Colombiana de la Propiedad Intelectual ACPI. |
| 3 | Comité de VIH de la ACIN (Asociación Colombiana de Infectología) |
| 4 | Asociación de Laboratorios Farmacéuticos de Investigación y Desarrollo - AFIDRO |
| 5 | AMIIF Asociación Mexicana de Industrias |
| 6 | Cavelier Abogados, en representación de las sociedades VIIV HEALTHCARE COMPANY, SHIONOGI & CO., LTD y GLAXO SMITHK COLOMBIA S. A |
| 7 | Colombia Saludable y Vocero Pacientes Colombia |
| 8 | Fundación IFARMA |
| 9 | Instituto de Ciencia Política Hernán Echavarría Olózaga - IC |
| 10 | Médicos sin fronteras - Access Campaign |
| 11 | ONUSIDA |
| 12 | Property Rights Alliance |
| 13 | José Luis Reyes Villamizar/Reyes & Reyes Abogados |
| 14 | Superintendencia de Industria y Comercio |
| 15 | Universidad Nacional de Colombia - UNAL |
| 16 | Pablo Felipe Robledo |
Que el 12 de septiembre de 2023 la Asociación de Laboratorios Farmacéuticos de Investigación y Desarrollo (AFIDRO) presentó una solicitud de recusación sobre la Directora de Medicamentos y Tecnologías en Salud del MSPS y de suspensión provisional del término de publicación del Informe de Recomendaciones del Comité Técnico Interinstitucional.
Que la solicitud fue resuelta por medio de la Resolución número 1481 del 19 de septiembre de 2023, publicada el mismo día en la página web de este Ministerio.
Que, resueltas las solicitudes elevadas, se ordenó continuar con el trámite administrativo.
2. DEL INTERÉS PÚBLICO
Que la doctrina ha definido el interés público como “la guía o criterio para tomar decisiones políticas y económicas que buscan promover la realización del bienestar o interés general de una sociedad por intermedio de la búsqueda de la satisfacción de las necesidades básicas de los ciudadanos”(1).
Correa Fontecilla definió el interés público, desde dos aspectos a saber: “[d] esde el punto de vista normativo o formal, el interés público estará representado por las intenciones elegidas y sancionadas por las autoridades mediante un procedimiento jurídico. Una concepción sustantiva o finalista, por su parte, se constituirá por el objetivo buscado con la actividad decisional de los poderes públicos. En estas dos situaciones es muy probable que la evaluación ética esté presente en la toma de decisión, con el propósito de mantener valores constantes”.
Que de acuerdo con el alcance conceptual expuesto y su aplicación práctica en Colombia, se comprende que el interés público se genera y desarrolla en el ámbito del Estado, ya que se encuentra entre los fines que necesariamente debe perseguir de conformidad con lo previsto en el artículo 2o de la Constitución Política, el cual dispone:
“Artículo 2o. Son fines esenciales del Estado. Servir a la comunidad, promover la prosperidad general y garantizar la efectividad de los principios, derechos y deberes consagrados en la Constitución; facilitar la participación de todos en las decisiones que los afectan y en la vida económica, política, administrativa y cultural de la nación; defender la independencia nacional, mantener la integridad territorial y asegurar la convivencia pacífica y la vigencia de un orden justo (…)”. (Negrilla fuera del texto original).
Que de esta manera, el interés público se instituye como un instrumento para alcanzar ciertas metas socialmente deseables o el interés general(2). En consecuencia, el interés público conlleva la toma de una serie de acciones encaminada a lograr la realización del bienestar o interés general, que en ocasiones significan limitar ciertas libertades o derechos de carácter individual.
Que en consecuencia, para determinar la existencia de un asunto de interés público se deben tener en cuenta las siguientes características: (i) que tenga contenidos estrechamente vinculados al bien común; (ii) que su aplicación contribuya a la realización de la dignidad humana, (iii) fortalezca los principios democráticos y la convivencia pluralista; (iv) que permita la evaluación de normas que contienen derechos y deberes constitucionales y legales, (v) y que integre un proceso de toma de decisión, materializado por órganos del Estado(3).
3. RELEVANCIA CONSTITUCIONAL, LEGAL Y JURISPRUDENCIAL DE LA ATENCIÓN DEL VIH EN COLOMBIA
Que el artículo 12 del Pacto Internacional de Derechos Económicos, Sociales y Culturales, adoptado por la Asamblea General de la Organización de Naciones Unidas (ONU), reconoce el derecho de toda persona al disfrute del más alto nivel posible de salud física y mental(4).
Que de esta manera, los Estados tienen la obligación de tomar medidas efectivas para garantizar que todas las personas, sin discriminación alguna, tengan acceso a los servicios de atención médica, incluyendo el acceso a medicamentos esenciales.
Que en concordancia con lo anterior, el artículo 49 de la Constitución Política dispone que “[l]a atención de la salud y el saneamiento ambiental son servicios públicos a cargo del Estado”, por esta razón es un deber constitucional garantizar “(…) a todas las personas el acceso a los servicios de promoción, protección y recuperación de la salud”, en tanto “[c]orresponde al Estado organizar, dirigir y reglamentar la prestación de servicios de salud a los habitantes (…) conforme a los principios de eficiencia, universalidad y solidaridad (…)”.
Que así mismo, la Ley 1751 de 2015 reiteró que el derecho a la salud es autónomo e irrenunciable en lo individual y en lo colectivo, “(…) [c]omprende el acceso a los servicios de manera oportuna, eficaz y con calidad para la preservación, el mejoramiento y la promoción de la salud (…). De conformidad con el artículo 49 de la Constitución Política, su prestación como servicio público esencial obligatorio, se ejecuta bajo la indelegable dirección, supervisión, organización, regulación, coordinación y control del Estado”.
Que por su parte, el literal a) del artículo 10 en lo relacionado con los derechos y deberes de las personas, en la prestación del servicio de salud, señala que “las personas tienen los siguientes derechos relacionados con la prestación del servicio de salud:
a) A acceder a los servicios y tecnologías de salud, que le garanticen una atención integral, oportuna y de alta calidad”. (Subrayado y cursiva fuera del texto original).
Que de lo dicho, se desprende sin duda alguna la obligación del Estado de garantizar la prestación del servicio de salud a todos los seres humanos sin distinción, en tanto se constituye como un derecho que tiene categoría autónoma y fundamental cuando se trata de amparar sujetos de especial protección, como es el caso de los pacientes portadores de VIH/SIDA, debido a que se encuentran en una situación de debilidad manifiesta a causa del deterioro progresivo de su estado de salud(5). Por ello, jurisprudencialmente se ha sostenido que “[e]l Estado se encuentra entonces en la obligación de brindarles atención integral y preferente en salud (…) en aras de garantizarles la vida y también por tener el Estado una posición de garante de la salubridad y el orden público”(6).
Que en este sentido, la Corte Constitucional precisó que en virtud del inciso 3 del artículo 13 superior 7, el Estado debe brindar especial protección a los enfermos de VIH y SIDA por su notoria(8) y en la sentencia T-228 de 2012 indicó que debe darse aplicación a la Ley 972 de 2005 el cual dispone la obligación del Estado de garantizar “el suministro de los medicamentos, reactivos y dispositivos médicos autorizados para el diagnóstico y tratamiento de las enfermedades ruinosas o catastróficas, de acuerdo con las competencias y las normas que debe atender cada uno de ellos”.
Que dicho lo anterior, vale anotar que la Ley 972 del 2005 determinó que a todas las personas residentes en Colombia que padecen de VIH/SIDA se les respetará y protegerá el derecho a la vida, por lo que en ningún caso se podrá afectar la dignidad de la persona. De manera específica, la ley declara de interés y prioridad nacional, la atención integral estatal a la lucha contra el VIH -Virus de Inmunodeficiencia Humana- y el SIDA -Síndrome de Inmunodeficiencia Adquirida-.
Que en este sentido, el parágrafo del artículo 4o de la precitada ley permite que el Gobierno nacional use los mecanismos normativos existentes para “garantizar el acceso de la población a los medicamentos que sean objeto de algún tipo de protección”. Señala textualmente este parágrafo lo siguiente:
“Artículo 4o. El Gobierno nacional a través del Ministerio de la Protección Social, diseñará en un término no mayor de seis (6) meses a partir de la promulgación de esta ley, unas estrategias claras y precisas conducentes a disminuir los costos de los medicamentos, reactivos y dispositivos médicos utilizados en las enfermedades de alto costo, en particular el VIH/SIDA, cuyas acciones serán de aplicación inmediata.
PARÁGRAFO. A partir de la vigencia de la presente ley, el Gobierno nacional, podrá hacer uso de los mecanismos que la normatividad le asigna con el fin de garantizar el acceso de la población a los medicamentos que sean objeto de algún tipo de protección”. (Subrayado fuera del texto original).
Que adicionalmente, de acuerdo con la Organización Panamericana de la Salud (OPS), la posibilidad o no de acceder a un medicamento constituye una de las manifestaciones más tangibles de las desigualdades e inequidades entre países en la región y entre poblaciones dentro de los países (9).
Que con forme a ello, se colige que no basta con adoptar medidas para garantizar el acceso a los medicamentos, sino que además el Estado debe asegurar un tratamiento integral, continuo y oportuno(10). En este sentido, la sentencia T-121/21 refuerza la tesis de que “las personas con VIH son sujetos de especial protección constitucional por la gravedad de su enfermedad y la condición de debilidad manifiesta en la que se encuentran”; asimismo la sentencia T-033/18 señala que, dada esta condición, las personas que viven con ella deben recibir un trato especialmente favorable por parte de las autoridades públicas y un comportamiento solidario por los miembros de la sociedad.
Que en coherencia con ello, la sentencia C-248/19 menciona que “los avances en materia de salud y el buen pronóstico de recuperación han permitido alejarse de la noción de enfermedad catastrófica al VIH, siempre que se encuentren dadas las condiciones de tratamiento adecuado que permita tratar y paliar los efectos de la enfermedad”, y la sentencia T-246/20 precisa que el “VIH/SIDA es una enfermedad catastrófica”.
Que teniendo en cuenta lo anterior, se procederá a analizar si concurren los elementos para declarar la existencia de razones de interés público para someter una patente de los medicamentos cuyo principio activo es el Dolutegravir a licencia obligatoria en la modalidad de uso gubernamental. Para lo cual, se analizará el Informe de Recomendaciones del Comité Técnico Interinstitucional y las observaciones presentadas por los terceros interesados, realizando las manifestaciones a que haya lugar.
4. OBSERVACIONES AL INFORME DE RECOMENDACIONES
4.1 De los argumentos expuestos por los terceros interesados
4.1.1. Daniel Hernández
Mediante correo electrónico de fecha 6 de septiembre de 2023, el médico especialista en medicina familiar y experto en VIH afirma que “la solicitud para que el DOLUTEGRAVIR pase a genérico:
1. Es lo mejor que le puede pasar al país, a los pacientes que viven con VIH y a los que atendemos dicha población.
2. Ya se ha realizado en otros países; con excelentes resultados en todos los aspectos.
3. Abre campo a más investigaciones; por ejemplo, en PrEP. (…)”.
4.1.2. Asociación Colombiana de la Propiedad Intelectual (ACPI)
ACPI manifiesta su desacuerdo con los argumentos expuestos por el Comité Técnico Interinstitucional, por considerar que el Gobierno nacional debe velar por la protección de la propiedad intelectual, por cuanto las patentes incentivan las inversiones en investigación y desarrollo, estimulando el crecimiento económico del país.
En este sentido, concluye que no respetar los lineamientos del ADPIC al otorgar licencias obligatorias puede desincentivar la inversión extranjera, causar impactos en las relaciones comerciales con otros países y disminuir el acceso a nuevas tecnologías, lo que, a su parecer podría limitar el acceso a nuevas innovaciones médicas y tecnológicas en el país.
4.1.3. Asociación Colombiana de Infectología
El Presidente del Comité de VIH de la ACIN sostiene que “es meritorio e imprescindible sin duda el encontrar mecanismos que permitan el acceso real de dolutegravir a la población que vive con VIH en Colombia, tanto como primer tratamiento como opción ante fallas o intolerancia a otras terapias previas, tal como lo recomienda la GPC 2021”.
No obstante, afirma que la recomendación de someter a licencia obligatoria las patentes de estos medicamentos, debe ser el último recurso cuando ya se han agotado todas las instancias de negociación con el propietario de la licencia. Por ello, considera que, aunque el documento de recomendación describe conversaciones con los titulares de las patentes, no es suficiente porque “no se informa de discusión o revisión de la alternativa de compras centralizadas de alto volumen”, lo cual es “un camino convencional que han seguido otros países de la región de ingresos medios y altos como lo son Brasil y México”.
Por último, “sostiene que el precedente que resulte de la licencia obligatoria a dolutegravir representará, con toda seguridad, un riesgo al ingreso y acceso en Colombia a nuevas tecnologías y medicamentos por parte de las compañías fabricantes multinacionales en el futuro inmediato.”.
4.1.4. Asociación de Laboratorios Farmacéuticos de Investigación y Desarrollo (AFIDRO)
La representante legal de la Asociación solicita al MSPS que se declare que no existen razones de interés público que ameriten continuar con el procedimiento, al considerar que las justificaciones del Comité desconocen la situación actual del VIH en Colombia.
Al respecto, menciona que, según los datos de la Cuenta de Alto Costo, para el 2022, en Colombia hubo una evidente mejoría en las cifras epidemiológicas del tratamiento contra el VIH porque el 88,3% de las personas diagnosticadas con VIH recibían tratamiento y el 78,1% de las personas que recibieron tratamiento tienen una carga viral suprimida, sin embargo, asegura que esta información no fue incluida en la gráfica 2 del documento de recomendaciones.
Aporta la siguiente tabla con información de personas que recibieron tratamiento y tienen carga viral suprimida:
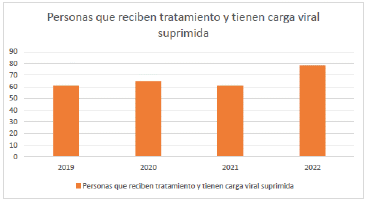
De acuerdo con esta gráfica, asegura que hubo un aumento del 20% en el porcentaje de personas que pudieron acceder al tratamiento contra el VIH y del 17% de las personas con carga viral suprimida, de forma que las medidas que se han tomado para atender la lucha contra el VIH han sido efectivas y no existe una situación de emergencia en el país.
Posteriormente, discute el test de razonabilidad que realiza el Comité Técnico. En el elemento de idoneidad considera que el informe desconoce que las licencias obligatorias no son el mecanismo adecuado para reducir los precios de un medicamento y hacerlo distorsionaría su naturaleza, más aún cuando ni el estudio Bienvenir, ni el documento titulado “path to end aids”, sugiere o recomienda incluir las licencias obligatorias como parte de la lucha contra el VIH, por el contrario, sugieren que las principales medidas sugeridas son de prevención.
En cuanto al elemento de necesidad, considera que existe un yerro en el informe porque no analiza ni contempla la posibilidad de que se ejecuten otros mecanismos, distintos a la licencia obligatoria de Dolutegravir para conseguir un impacto positivo en la lucha contra el VIH.
En lo referente al elemento de proporcionalidad de la medida, asevera que no se contempló otra posibilidad para lograr la finalidad requerida, o los efectos negativos que podría generar una eventual licencia obligatoria, tales como:
(i) Un posible incumplimiento de las obligaciones internacionales que Colombia ha adquirido con Estados Unidos, Japón y Reino Unido.
(ii) La posibilidad de que, por esa vía, la reclamación pueda terminar con una demanda inversionista-Estado, y la eventual orden de un Tribunal de Arbitramento para que Colombia indemnice al inversionista por la expropiación de su propiedad.
(iii) Los costos que supondría una defensa en procesos internacionales, que supone un alto costo operativo, político y económico para el país.
(iv) El mensaje negativo y la inseguridad jurídica atada a otorgar una licencia obligatoria sin el cumplimiento de los requisitos y elementos establecidos por la Ley, la jurisprudencia y la normatividad internacional.
(v) El deterioro en la confianza de potenciales inversionistas en Colombia.
(vi) El efecto paralizante que puede generar una licencia obligatoria sobre la innovación. Algunos de los países que aprovechan las licencias obligatorias han visto disminuir o estancar las importaciones de medicamentos y han experimentado retrasos en el lanzamiento de nuevos medicamentos y tratamientos. Esto podría ocurrir en Colombia.
Por último, sugiere que en caso de existir razones de interés público para someter la patente a licencia obligatoria, se limite la licencia obligatoria únicamente a los medicamentos sugeridos por el Comité Técnico dentro de la tabla 16 del Informe de recomendaciones.
4.1.5. AMIIF - Asociación Mexicana de Industrias
Expone que la licencia obligatoria que recomienda el Comité carece de un análisis detallado acerca de la necesidad de la licencia en la medida que no indica las (i) situaciones de desabastecimiento que impidan el adecuado suministro del medicamento o (ii) las razones por las cuales el precio del dolutegravir restringe el acceso al mismo.
Deduce que la recomendación no se encamina a fomentar la protección de la propiedad intelectual, contrario a ello, omite este análisis en tanto no se abordó en el test de proporcionalidad los beneficios de la investigación para la protección del derecho a la salud.
Finalmente, concluye que la recomendación puede generar el riesgo de ralentizar la investigación y desarrollo de otras terapias antirretrovirales, más allá de las enfocadas al VIH.
4.1.6 Cavelier Abogados
La firma de abogados en representación de VIIV HEALTHCARE COMPANY, SHIONOGI & CO., LTD y GLAXOSMITHKLINE COLOMBIA S. A., expone su desacuerdo con la recomendación del Comité Técnico Interinstitucional y solicita no acoger las recomendaciones, por las siguientes razones a saber:
En primer lugar, considera que el trámite de declaratoria de interés público y el informe de recomendaciones presentaron fallas procedimentales y de fondo, razón a que este último fue “informado a los terceros interesados de manera incompleta, pues no incluyó piezas procesales y probatorias en las que el mismo documento hace referencia expresa” y no se resolvió la solicitud de aclaración y revocatoria directa presentada contra el auto de pruebas, antes de la publicación del informe de recomendaciones.
En segundo lugar, asevera que existe una falta de claridad sobre el origen de la información incluida en el informe del Comité, por cuanto el Comité incluyó información que no fue aportada por el MSPS y mucho menos por los terceros interesados.
En tercer lugar, deduce que el informe descontextualiza los hechos analizados para llegar a la conclusión de que la declaratoria de interés público es la medida apropiada para el caso colombiano. En este sentido sostiene que las licencias son de carácter excepcional y no pueden ser un mecanismo válido para buscar la reducción de precios a menos que exista una situación de emergencia u otra circunstancia extraordinaria en la que sea el precio lo que impida el acceso al derecho a la salud.
Indica que para alcanzar el objetivo 95-95-95 no resulta indispensable tener una licencia obligatoria con respecto al Dolutegravir, ya que este objetivo requiere una serie de medidas adicionales y “abarca muchos más aspectos que simplemente tener a menor precio tan solo una de las distintas alternativas terapéuticas disponibles en el mercado”.
Añade que existen otros esquemas de tratamiento posibles como el Bictegravir, el cual cuenta con registro INVIMA 2021M-0020165 y registra ventas destinadas al SGSSS, y en cualquier caso “es el médico tratante en su autonomía y análisis de pertinencia quien define el mejor tratamiento de acuerdo con el perfil del paciente. Los testimonios de médicos expertos no aceptados en el proceso por el Ministerio precisamente tenían como objeto clarificarle esto al Comité y mostrarle cómo se toman las decisiones de tratamiento en la práctica clínica local, más allá de las recomendaciones de la Guía y cómo Dolutegravir no es la única alternativa disponible para las personas viviendo con VIH”.
De otro lado, explica que las cifras analizadas en el informe contienen imprecisiones y no logran demostrar que la epidemia se encuentra en un punto crítico excepcional que justifique la declaratoria de interés público con fines de licencia obligatoria. Por ello, considera que el informe carece de rigurosidad técnica en el reporte de la información.
Sumado a ello asegura que el informe clasifica de forma errónea la situación epidemiológica del VIH en la población migrante como epidemia generalizada y la condición epidemiológica definida para la población migrante guarda relación con una epidemia concentrada.
Así mismo, argumenta que no existe evidencia de que la baja prescripción del Dolutegravir se deba a su precio. Considera incongruente que una prescripción reducida de un tratamiento sea equivalente a una falta de acceso ya que no existe una deficiencia en el suministro de un medicamento recetado ni existen problemas comprobados en la disponibilidad de este para cubrir la necesidad de la población que lo requiere.
Hace un análisis de la evaluación económica del medicamento para concluir que el informe muestra un ahorro significativo y sustancial en el gasto público, pero ello puede no corresponder a la realidad en el tiempo presupuestado porque reitera, se excluyen factores importantes como la autonomía médica y las condiciones de cada paciente.
Por último, profundiza en el test de razonabilidad previsto en la interpretación 144- IP-2019. Allí argumenta que el Comité no acredita la relación de causalidad entre la implementación de la licencia obligatoria y el acceso al tratamiento de las personas de los grupos objetivo señalados en el informe, toda vez que la medida que se pretendería implementar (i) no es adecuada o idónea para la finalidad propuesta, en tanto no existe evidencia alguna de que la disminución del precio del medicamento Dolutegravir conlleve a la eliminación de las barreras de acceso debidamente identificadas. (ii) Tampoco la considera necesaria porque ni las consideraciones impartidas por el Comité, ni la realidad actual del país en relación con el tratamiento del VIH/SIDA dan cuenta de la extrema urgencia que ameriten la intervención estatal a través de una licencia y (iii) no es proporcional a la limitación de los derechos al no existir garantía de que la licencia conlleve un aumento de la tasa de pacientes atendidos con Dolutegravir.
4.1.7. Fundación ANCLA de Medellín, la Organización Pacientes Colombia, Asociación Colombia Saludable y Mecanismo de Apoyo control en VIH de Colombia - MSACVCO
El Director de la Asociación Colombia Saludable, en nombre de la Fundación ANCLA de Medellín, la Organización Pacientes Colombia, la Asociación Colombia Saludable y el Mecanismo de Apoyo control en VIH de Colombia - MSACVCO, sugiere que se busquen otras alternativas para garantizar el acceso a los medicamentos para el VIH como, por ejemplo, la negociación de precios más bajos con las empresas farmacéuticas.
Lo anterior teniendo en consideración, entre otras razones, que:
“(…)
- No hay escases y/o desabastecimiento del medicamento en el país; no es un medicamento que genere monopolio porque tiene competidores; este es un medicamento regulado y que está en control de precios, porque lo que consideramos que no cuenta con criterios técnicos para pedir su patente pública.
(…)
- Por otro lado, existe un componente legal el cual no podemos desconocer sobre la autonomía médica, donde se le da la garantía al profesional de la salud para que pueda emitir con toda libertad su opinión profesional con respecto al tratamiento de sus pacientes con calidad, normas, principios y valores de su profesión, presente en el artículo 105 de la Ley 1438 de 2011.
(…)
- Desde las agrupaciones de pacientes, el principal argumento para evitar que se rompan patentes para medicamentos de VIH sería la preocupación por la calidad y seguridad de los medicamentos genéricos que podrían surgir como resultado de la eliminación de la patente.
- Aunque los medicamentos genéricos pueden ser una alternativa más económica, es importante asegurarse de que cumplan con los mismos estándares de calidad y seguridad que los medicamentos originales. Si se rompe la patente, es posible que se abra la puerta a la producción de medicamentos genéricos de baja calidad que podrían poner en riesgo la salud de los pacientes.
(…)”.
4.1.8 Fundación IFARMA Colombia, Richard Stern, Fundación Grupo Efecto Positivo Argentina, RedLAM (Red Latinoamericana por el Acceso a Medicamentos), Red Argentina de Personas Positivas, Sergio Isaza Villa, Óscar Andia Salazar, Sandra Ávila AHF, John Harold Estrada M. ALAMES - Colombia, Aids HealthCare Foundation Colombia, FEDESALUD. Colombia, Acción Internacional para la Salud - Perú. G.T.P.I. Grupo de Trabalho sobre Propriedade Intelectual Brasil, Asociación ABIA. Brasil, Fundación Tradición Oral Colombia, Salud y Fármacos Estados Unidos, Andrea Carolina Reyes Rojas, Fundación Comunicación Positiva Colombia, David Morales Alba, World Association for Christian Communication (WACC), Liga Colombiana de Lucha contra el SIDA.
Las personas y organizaciones firmantes apoyan la recomendación del comité porque permite reducir barreras de acceso. Sugieren tener en cuenta que los precios de los antirretrovirales afectan a las personas con VIH, en factores como: la idoneidad del medicamento elegido y la continuidad del tratamiento para complementar las entregas periódicas del medicamento. Manifiestan expresamente que:
“(…) las personas en tratamiento se quejan de los frecuentes cambios de esquema, situación que es consecuencia de las negociaciones comerciales o la influencia de las compañías farmacéuticas sobre los prescriptores, sin dar prioridad a las necesidades del paciente.
Así mismo, las entregas incompletas e inoportunas, los incumplimientos y el irrespeto al tiempo de las personas que necesitan los tratamientos que representan las autorizaciones, han hecho necesaria la existencia de organizaciones de personas afectadas para presentar permanentemente reclamos y la implementación de diversos esquemas de bancos de medicamentos, totalmente financiados y sostenidos por los pacientes y sus organizaciones. Esta situación, con la que hemos convivido los últimos años, se ha agravado recientemente.
Los profesionales de la salud, los prescriptores y los pacientes celebramos la aparición de los inhibidores de la integrasa y en particular del dolutegravir, tanto por las ventajas en cuanto a efectos secundarios, como por la eficacia y la reducción de la resistencia. Celebramos la recomendación técnica de la OMS y celebramos igualmente que haya sido incluido en la Guía de Práctica de Clínica de nuestro país.
Sin embargo, no tenemos duda de que su precio es un factor que explica su pobre utilización en nuestro país. Las instituciones especializadas continúan utilizando esquemas más baratos que representan desventajas terapéuticas.
(…)”.
Aseguran que la situación de la población migrante con VIH es dramática porque, al regularizar su situación migratoria, son cambiados a tratamientos más económicos, con mayores efectos secundarios y menor eficacia.
Rechazan las afirmaciones que sugieren que la licencia obligatoria sería contraria a los compromisos y acuerdos internacionales, y comprenden que la calidad del genérico debe ser asegurada por el Ministerio de Salud y el Invima.
4.1.9. Instituto de Ciencia Política Hernán Echavarría Olózaga
El Director Ejecutivo del Instituto, Dr. Carlos Chacón Monsalve, manifiesta su desacuerdo con el informe de recomendaciones al considerar que resulta insuficiente e inconveniente, toda vez que desconoce que la innovación impulsada por las patentes desempeña un papel fundamental en el desarrollo y crecimiento económico.
Exponen que, de acuerdo con el Fondo Colombiano de Enfermedades de Alto Costo, existe un buen nivel de cobertura y disponibilidad de medicamentos para la población afectada, tanto así que para el 2022 el país alcanzó el aseguramiento en salud con un 99,6% de cobertura.(11) Esto lo lleva a concluir que, no existe un problema de acceso o cobertura que justifique la declaración de interés público.
Al igual que otros intervinientes, asegura que en el país existen otros mecanismos (diferentes a las licencias obligatorias) desarrollados para disminuir el precio de medicamentos.
Recuerda que los derechos de propiedad han sido reconocidos como derecho fundamental en la Constitución Política, lo cual otorga confianza para el desarrollo de innovación, tecnología e inversión; ello podría verse afectado con una licencia obligatoria porque ello desestimula la investigación y el desarrollo de nuevos medicamentos, además de afectar la calidad de los productos.
Concluye que el informe desconoce la importancia de la propiedad intelectual frente al desarrollo de una industria farmacéutica innovadora que ofrece productos de calidad.
4.1.10. Medecins Sans Frontieres/Doctors Without Borders (MSF)
Informa su apoyo al informe de recomendaciones del Comité Interinstitucional porque a su juicio, aporta argumentos convincentes para la declaratoria de razones de interés público para emitir una licencia obligatoria para el dolutegravir, y que ello permitiría adquirir versiones genéricas asequibles para ampliar el acceso al tratamiento de VIH.
Indica su traducción:
“MSF es una organización no gubernamental médica humanitaria internacional e independiente que brinda asistencia médica en más de 70 países a personas afectadas por conflictos, epidemias, desastres y exclusión de la atención médica. En su trabajo diario, como proveedor de tratamiento y comprador de medicamentos, MSF ha experimentado de primera mano cómo los monopolios impiden el acceso a tratamientos asequibles que salvan vidas para las personas bajo nuestro cuidado.
Hemos sido testigos repetidas veces del impacto negativo del uso excesivo de la propiedad intelectual, en particular de las patentes y otras exclusividades, como la exclusividad de datos, sobre el acceso a medicamentos que salvan vidas por parte de las personas que los necesitan. Estas protecciones de la propiedad intelectual socavan la capacidad de los países para brindar acceso al tratamiento del VIH/SIDA, la tuberculosis (TB), la hepatitis C y el cáncer 1, 2, 3, Dolutegravir se añadió a las directrices de tratamiento del VIH de la Organización Mundial de la Salud en 2016. MSF ha utilizado ampliamente un régimen de primera línea basado en dolutegravir en sus programas de VIH/SIDA en África y Asia, y en varios países de América Latina, y ha observado que los pacientes se benefician de menos efectos secundarios y un menor riesgo de resistencia (…).
MSF quisiera enfatizar que la emisión de una licencia obligatoria por parte del Gobierno colombiano sería una acción totalmente legal y legítima según el Acuerdo de la Organización Mundial del Comercio sobre Derechos de Propiedad Intelectual Relacionados con el Comercio (ADPIC) y la Declaración de Doha sobre los ADPIC y la Salud Pública. Las investigaciones muestran que las licencias obligatorias han sido consideradas o utilizadas por diferentes países casi 100 veces en las últimas dos décadas como una medida legítima para permitir el acceso a los medicamentos (…)”.
4.1.11. ONUSIDA para los países de la Región Andina
La Directora de ONUSIDA agradece al Comité Técnico la consideración e inclusión de las recomendaciones técnicas en el informe de recomendaciones. Resalta que este documento contiene el marco normativo internacional, regional y nacional, brinda antecedentes y buenas prácticas de procesos similares en otros países, además analiza la razonabilidad de la declaratoria y comparte otras alternativas exploradas para atender la situación de interés público. A pesar de ello, realiza las siguientes recomendaciones técnicas:
“(…)
- Página 31: Se hace referencia al posible impacto del incremento en la transmisión del VIH a la población general debido a la alta prevalencia de VIH encontrada en la población migrante. Esta línea de análisis pudiera interpretarse como una forma de responsabilizar a las personas migrantes con VIH de la transmisión de la infección a la población general, con riesgo de estigmatizar a dicha población. Es importante tener en cuenta que la población colombiana con VIH que no recibe tratamiento de primera línea es la más afectada al no tener acceso a dicha opción. Sugerimos hacer referencia a que el acceso a derivados del dolutegravir asequibles, ampliará el acceso y la cobertura de tratamiento a toda la población con VIH en territorio colombiano, incluidos los y las migrantes.
- Pagina 41: Cuando se hace referencia al desafío para garantizar el acceso al tratamiento de primera línea, sugerimos hacer referencia a que esta licencia obligatoria eliminaría una de las principales barreras de acceso a tratamiento de primera línea del VIH en Colombia, y contribuirá a alcanzar las metas globales de prevención y tratamiento del VIH de la Estrategia Global de SIDA 2021-2026 (metas 95-95-95), para terminar con el SIDA como un problema de salud pública para 2030 y cumplir con el Objetivo de Desarrollo Sostenible (3.3). Esto en el marco de la adhesión de Colombia a la Declaración Política sobre el VIH y el SIDA 2021 de la Asamblea General de las Naciones Unidas: Acabar con las desigualdades para poner fin al SIDA para 2030.
- Pagina 43: Cuando se hace referencia a que las organizaciones de base comunitaria han referido dificultades de acceso relacionadas con el estigma y la discriminación en el sector salud, sugerimos hacer referencia a los hallazgos y recomendaciones del informe “Romper el Círculo- índice de estigma y discriminación en personas con VIH/SIDA en Colombia” 2022, elaborado bajo el Protocolo diseñado a través de convenio del MINSALUD UNFPA y la UT Atona (liga sida-recolvih -redsomos) revisado y ajustado con el concurso de ENTerritorio.
(…).”.
4.1.12. Property Rights Alliance
Manifiesta su preocupación por el desconocimiento de los derechos de propiedad intelectual, con los que se busca la inversión, el crecimiento económico y el desarrollo integral de las naciones. Pone de presente que los derechos a la propiedad intelectual hacen posible que el sector privado invierta recursos en tecnología de vanguardia tales como la inteligencia artificial y el transporte espacial, permitiendo que se desarrollen invenciones para mejorar la calidad de vida de la población y a su vez, este progreso tecnológico asegura una mayor expectativa de vida.
Considera que levantar la patente de los medicamentos contra el sida, implica una intromisión del Gobierno en los asuntos del sector privado y perjudicará la inversión extranjera directa que llega al país.
4.1.13. José Luis Reyes Villamizar
El tercero interesado a través de la firma Reyes & Reyes Abogados solicita proceder con la mayor celeridad en el trámite de declaratoria de razones de interés público para el otorgamiento de licencias obligatorias de medicamentos cuyo principio activo es el dolutegravir y acoger las recomendaciones del Comité, con fundamento, entre otras, en las siguientes argumentaciones:
- El MSPS cuenta con competencia para declarar la existencia de razones de interés público para garantizar el derecho a la salud.
“(…)
Tomando en consideración que, tal como se verá más adelante, tanto la Declaración de Doha de 2001, como los documentos CONPES expedidos por el Estado Colombiano para la promoción de la salud, en especial, en lo referente a la prevención y tratamiento del VIH, reconocen que es del resorte del país desarrollar las políticas que estime convenientes para afrontar afecciones a la salud entre su población, es dable concluir que el Ministerio de Salud y Protección Social se encuentra facultado para llevar a cabo el presente trámite de declaración de razones de interés público (...).
Por tal motivo, el Ministerio de Salud no puede sustraerse de dicho deber, como pretenden algunos intervinientes en el presente trámite, bajo el pretexto de que las disposiciones andinas no habrían regulado detalladamente lo relativo a la declaratoria de razones de interés público para el otorgamiento de licencias obligatorias en materia de patentes. (…)”.
- El MSPS se encuentra legitimado para adelantar la actuación administrativa en virtud del principio de complemento indispensable.
“(…) Nótese que, contrario a lo manifestado por algunos intervinientes, en realidad, en tanto se encuentre debida y razonablemente justificada la declaratoria de razones de interés público, los Estados conservan la facultad de reglamentar el procedimiento requerido para que proceda dicha declaratoria, sin que por ello se pueda afirmar que un Estado que procede de dicha manera, como lo está haciendo el Estado Colombiano en el presente procedimiento, se encuentra transgrediendo las normas comunitarias, pues insisto, en tanto la 'causa' y el 'efecto' de la declaratoria de existencia de razones de interés público se encuentren debidamente soportados, no se podrá afirmar que el Estado ha violado las normas comunitarias (…)”.
- La declaratoria de razones de interés público no desconoce el espíritu de la Decisión 486 de 2000.
“(…) Bajo estas circunstancias, no existen fundamentos para que en el presente trámite se cuestione la legalidad de la actuación del Ministerio de Salud, soportados en una supuesta transgresión de las normas comunitarias andinas, pues además de que dichas normas no regulan ni reglamentan los mecanismos que cada Estado debe implementar para proceder a realizar una declaratoria de razones de interés público, diversos instrumentos internacionales, en particular el tratado ADPIC y la Declaración de Doha, legitiman a los Estados para que reglamenten con plena autonomía la manera en que se debe proceder para realizar tal declaración”.
- El asunto es de interés general porque afecta la salud pública de los colombianos, por ende, el Estado debe velar por garantizar el derecho de la salud a la población de especial protección constitucional.
Incluye en sus observaciones la intención de laboratorios Richmond Colombia S. A. para suministrar el medicamento al Estado Colombiano.
4.1.14 Superintendencia de Industria y Comercio
Destaca la importancia de aclarar y precisar las patentes que serán objeto de declaración de interés público, indicando si la eventual declaración abarcaría la patente de invención otorgada dentro del radicado número 07115501, o únicamente aquella que se encuentra protegida con ocasión de la concesión del expediente número 07115501A, o, si por el contrario recaería sobre las dos patentes mencionadas en el cuerpo de las Recomendaciones del Comité Técnico Interinstitucional.
Lo anterior, teniendo en cuenta que “si bien es cierto que las dos patentes antes referidas comparten la misma descripción, que ella hace mención al compuesto dolutegravir y la patente con radicado N° 07115501, tal como fue inicialmente presentada incluía el mencionado compuesto, al efectuarse la división de dicha solicitud, se eliminó del alcance de la invención protegida mediante la patente concedida en el radicado N° 07115501 el compuesto cuya fórmula corresponde al dolutegravir, quedando dicho compuesto protegido únicamente por el alcance de las reivindicaciones otorgadas en la solicitud divisional que arribó a la concesión de la patente con radicado N° 07115501A.
(…)
Considera que la fórmula del compuesto Dolutegravir no corresponde con los compuestos definidos y protegidos mediante las reivindicaciones 1 y 2 de la solicitud de patente número 07115501.
Sin embargo, que dicho compuesto sí está comprendido dentro del alcance de la protección conferida por la patente con radicado N° 07115501A, como se demostró anteriormente, por lo que se encuentra protegido mediante patente de invención y su vigencia se extiende hasta el 28 de abril de 2026”.
4.1.15 Universidad Nacional de Colombia
El Director del Grupo de Investigación Plebio de la Universidad Nacional expone sus observaciones al informe de recomendaciones desde un punto de vista académico. Primero manifiesta que, el inicio de oficio de la actuación administrativa es legal y ajustada a derecho. Aclara que las licencias obligatorias no son expropiaciones y tampoco están reservadas únicamente para casos de emergencia.
Sugiere “que el Gobierno trabaje en criterios estrictos de patentabilidad. Tema de competencia de la SIC-Superintendencia de Industria y Comercio, pero donde también deberían escuchar a MinSalud. Todo en aras de lograr equilibrios en titulares de PI y usuarios de PI como lo mencionan las bases del Plan de Desarrollo. En este caso titulares de patentes de medicamentos de un lado, y, de otra parte, sistema de salud, presupuesto nacional, y pacientes”.
Exhorta a las empresas a considerar el otorgamiento de licencias voluntarias para demostrar una verdadera voluntad en pro del acceso a los medicamentos.
Explica que, aunque en ocasiones se pueden lograr reducciones en el precio de los medicamentos a través de la compra centralizada, lo cierto es que no es tan eficiente como en escenarios de competencia habilitada por la licencia obligatoria o de uso gubernamental.
Destaca la importancia de aclarar si se trata de una licencia obligatoria o de uso gubernamental, pues haber iniciado la actuación de oficio, per se, no es suficiente para considerar que es de uso gubernamental.
4.1.16 Pablo Felipe Robledo del Castillo
Acerca del informe de recomendaciones del Comité Técnico, expone que el argumento central para la declaratoria de interés público es el precio del medicamento, sin demostrar una situación de falta de acceso por parte de la población colombiana a los tratamientos para el VIH. Al respecto, considera que este análisis del Comité contradice la postura acogida por el Ministerio de Salud y Protección Social en otras actuaciones administrativas similares, en donde se dispuso que no existen razones para declarar interés público el acceso bajo condiciones de competencia al medicamento antirretroviral Lopinavir Ritonavir (Kaletra).
Añade que de conformidad con la Resolución 2808 de 2022 expedida por este Ministerio, el Dolutegravir es un medicamento incluido en el Plan de Beneficios en Salud, ello significa que no se encuentra restringido a una parte específica de la población, incluida la población migrante.
Por las anteriores consideraciones, sostiene que no se cumple con los requisitos establecidos por el Tribunal Andino de Justicia.
Finalmente eleva una serie de inquietudes relacionadas con el VIH en el país y las medidas alternativas para lograr el objetivo de este Ministerio.
4.2. Consideraciones del Ministerio de Salud y Protección Social frente a las observaciones de los interesados
Con el ánimo de realizar un pronunciamiento integral de las observaciones recibidas, este Ministerio procederá de la siguiente manera: En primer lugar, se expondrán unas consideraciones generales respecto de aquellos argumentos comunes entre los intervinientes y, posteriormente, se referirá a las consideraciones específicas restantes que fueron presentadas.
4.2.1. Consideraciones a las observaciones con argumentos comunes
4.2.1.1. De la facultad del Estado para la declaratoria de interés público con fines de licencia obligatoria en la modalidad de uso gubernamental
Que el Acuerdo multilateral sobre los Aspectos de los Derechos de Propiedad Intelectual relacionados con el Comercio (ADPIC), establece las normas mínimas en las esferas de propiedad intelectual correspondientes, entre otras, a patentes de invención(12).
Que los objetivos establecidos en su Preámbulo deben leerse en concordancia con lo previsto en los artículos 7 y 8 del mismo acuerdo. Específicamente, el artículo 7 indica: que la protección y la observancia de los derechos de propiedad intelectual deberán contribuir a la promoción de la innovación tecnológica y a la transferencia y difusión de la tecnología, en beneficio recíproco de los productores y de los usuarios de conocimientos tecnológicos de modo que favorezcan el bienestar social y económico y el equilibrio de derechos y obligaciones.
Que por su parte, en el artículo 8 se establecen los principios y se reconoce el derecho de los Miembros a adoptar medidas por motivos de salud pública y otras razones de interés público y a prevenir el abuso de los derechos de propiedad intelectual, a condición de que tales medidas sean compatibles con las disposiciones del Acuerdo sobre los ADPIC.
Que para lograr lo antes mencionado, el mismo Acuerdo en su artículo 31 contempla los denominados “usos sin autorización del titular de los derechos”(13), dando potestad a los Estados de utilizar estas herramientas para proteger el interés público.
Que el derecho de los miembros de la Organización Mundial del Comercio (OMC) de utilizar estas herramientas fue ratificado a través de la Declaración de Doha en 2001, con el propósito de proteger la salud pública.
Que teniendo en cuenta esta normatividad y de acuerdo con el Programa Conjunto de las Naciones Unidas sobre el VIH/SIDA (ONUSIDA)(14), las licencias obligatorias son “mecanismos mediante los cuales las autoridades públicas pueden autorizar el uso de un invento patentado por parte del Gobierno o de terceros sin necesidad de contar con la autorización del titular de la patente”.
Que lo anterior permite evidenciar que, contrario a las afirmaciones realizadas por algunos de los intervinientes, las licencias obligatorias no corresponden a una expropiación ni a un “retiro forzoso” de la patente al titular. De hecho, la decisión 486 establece que el otorgamiento de una licencia no limita el derecho del titular a explotar la patente afectada (15).
Que adicional a lo anterior, es importante destacar que las licencias obligatorias de productos farmacéuticos pueden tener efectos positivos directos en la salud pública. En este sentido ONUSIDA señala que “(…) estas opciones de políticas y otras flexibilidades pueden contribuir, directa o indirectamente, a incrementar el suministro y la disponibilidad de los medicamentos necesarios, permitiendo que los países con ingresos bajos y medios alcancen un equilibrio entre la protección de la propiedad intelectual y prioridades específicas de desarrollo como la consecución de los objetivos nacionales en materia de salud pública” (16). (Subrayado fuera del texto original).
Que por lo anterior, en Colombia, como país miembro de la Comunidad Andina de Naciones (CAN), en materia de protección de la propiedad industrial rige la Decisión 486 del año 2000.
Que esta decisión en su Título II, regula lo referente a las patentes de invención y en el Capítulo VII, desarrolla el régimen de las licencias obligatorias, estableciendo las condiciones para su concesión en el artículo 65, el cual indica que una de las razones para conceder la Licencia obligatoria corresponde a la existencia de razones de interés público.(17)
Que, como fue mencionado en el Informe de Recomendaciones, este artículo fue objeto de la interpretación prejudicial 144-IP-2019 del 16 de marzo de 2021 del Tribunal de Justicia de la Comunidad Andina(18). Allí el Tribunal precisó que:
- “[e]l régimen de propiedad industrial de la Comunidad Andina dispone que una licencia obligatoria puede ser adoptada bajo los siguientes supuestos: (i) por la falta de explotación de la patente; (ii) la existencia de razones de interés público, de emergencia, o de seguridad nacional; (iii) ante la presencia de conductas anticompetitivas, especialmente el abuso de la posición de dominio; o, (iv) cuando el titular de una patente requiere, para explotarla, necesariamente del empleo de la patente de otro” (subrayado por fuera del texto original).
- “(...) la licencia obligatoria no es una “excepción”, sino una limitación al derecho de propiedad industrial, pues, mientras la primera se caracteriza por tener un alcance general, la segunda, que es la institución que nos ocupa, tiene carácter particular, en el sentido de que se concede por la autoridad competente caso por caso si las circunstancias lo justifican”.
- “Otras razones de interés público pueden ser el uso público no comercial, la necesidad de que la población tenga acceso a determinados productos (v.g., medicamentos, alimentos), la protección ambiental, entre otros”. (Subrayado fuera del texto original).
- “La accesibilidad a medicamentos es una razón válida de interés público que justifica el otorgamiento de una licencia obligatoria, al amparo del artículo 65 de la Decisión 486, con el objeto de proteger de manera permanente la vida y salud de los ciudadanos. Otra razón válida es la existencia de una emergencia sanitaria (v.g., una pandemia)(19)“ (Subrayado fuera del texto original).
Que así mismo, el Tribunal indicó puntualmente que “(...) una interpretación correcta del mencionado párrafo [párrafo del artículo 65 de la Decisión 486] permite afirmar que, si bien el legislador andino previó tres supuestos conceptualmente diferenciados, lo cierto es que todos ellos responden a un interés público.
Ello es relevante a efectos de precisar que la mención a “interés” público en el tercer párrafo del referido artículo debe entenderse como al género y no a la especie, en el sentido de que todas las licencias obligatorias (por razones de interés público, de emergencia y de seguridad nacional) no menoscaban el derecho del titular de la patente a seguir explotándola. En efecto, el género son las “razones de interés público” y sus especies “las situaciones de emergencia”, “las razones de seguridad nacional” y “otras razones también califiquen como interés público (Subrayado fuera del texto original).
Que de lo anterior, se tiene que, en virtud del artículo 65 de la Decisión 486 de 2000, se puede someter una patente a licencia obligatoria si el fin que se tiene con esta es proteger un interés público, como lo es de uso público no comercial, y/o el acceso a medicamentos que protejan la vida y salud de los ciudadanos, sin que ello afecte injustificadamente los derechos a la propiedad intelectual de los titulares de las patentes.
Que además, esta modalidad ha sido utilizada intensamente en otros países, como fue explicado de manera detallada en el informe de recomendaciones, por ejemplo, en Estados Unidos, donde cualquier ministerio puede decidir el uso de una invención patentada en cualquier momento desde su concesión, aún sin comunicarlo previamente al titular de la patente(20) o el Gobierno de Indonesia que, para antirretrovirales en 2004 “autorizó al Ministro de Salud a designar un “fabricante farmacéutico” para explotar una patente en nombre del Gobierno. La autorización se basó en el Decreto Presidencial número 83 de 2004 'Regarding Exploitation of Patent by the Government on Antiretroviral Drugs for Government use'. De acuerdo con la bibliografía disponible, el Gobierno logró un ahorro sustancial con esa autorización”(21).
Que, así mismo, como lo indicó el Comité, en 2005 el Gobierno de Ghana dictó una medida de uso gubernamental que permitió la importación de medicamentos genéricos de la India para el VIH/SIDA alcanzando ahorros de más de 50% en el costo de tratamiento que pasó de U$S 495 a U$S 235 por año/paciente”(22).
Que en América Latina, la figura de licencia obligatoria ha sido utilizada en 2 países, Brasil y Ecuador. En 2007, Brasil haciendo uso de la normatividad vigente, otorgó una licencia obligatoria sobre las patentes del efavirenz. En 2010, Ecuador otorgó una licencia obligatoria para el ritonavir hasta el vencimiento de la patente en 2014(23).
Que como muestra de la gran acogida de esta figura, se ha hecho una recopilación de datos sobre licencias obligatorias o de uso gubernamental otorgadas en el mundo, así como el sobre los precios, donde se evidencia que los precios se reducen entre un 24% y 99%(24).
Tabla 1. Casos seleccionados de emisión de licencias obligatorias/uso gubernamental. Precios en US$ y ahorros porcentuales
| País | Año | Tecnología sanitaria | Patente (previo a la licencia obligatoria) | Genérico (luego de la licencia obligatoria) | Monto ahorro | % ahorro |
| Zimbaque | 2003 | Lamivudina/ zidovudina | US$197- US$ 237 por paciente año | US$ 15 por paciente por mes (US$ 180 por paciente año*) | Entre US$17 y US$57 por paciente año** | (-8.6;- 24) |
| Ghana | 2005 | ARV | US$495 por año/paciente | US$235 por año/ paciente | US$260 por año/ paciente | (-52) |
| Malasia | 2003 | Estavudina + Didanosina + Nevirapina | US$261,44 por paciente por mes, año 2001 | US$45.32 por paciente por mes 2004 | US$216.12 por paciente por mes | (-83) |
| Malasia | 2003 | Combivir + efavirenz | US$362.63 por paciente por mes, año 2001 | US$115.14 por paciente por mes año 2004 | US$247.49 por paciente por mes | (-68) |
| Indonesia | 2004 | Lamiduvina/ zidovudina/ nevirapina | US$60 por 60 tabletas | US$18-US$65 por 60 tabletas | Entre US$582 y 535 por 60 tabletas | (-97,-89) |
| Indonesia | 2004 | Lamivudina (3TC) | US$290-330 por 60 tabletas*** | US$28 por 60 tabletas | Entre US$302 y 262 por 60 tabletas | (-91) |
| Indonesia | 2004 | Nevirapina | US$96 por 60 tabletas | US$28 por 60 tabletas | US$68 por 60 tabletas | (-71) |
| Indonesia | 2004 | Combivir | US$400 por 60 tabletas | US $48,60 por 60 tabletas | US$351,4 por 60 tabletas | (-88) |
| Tailandia | 2006 | Efavirenz | US $58 por mes de tratamiento | US$7.5 por mes de tratamiento | US$50.5 por mes de tratamiento | (-87) |
| Tailandia | 2007 | Lopinavir/ ritonavir | US$1.800 por año de tratamiento | US$600 por año de tratamiento | US$1.200 por año de tratamiento | (-67) |
| Tailandia | 2007 | Clopidogrel | US$3 por año de tratamiento | US$0.06 por año de tratamiento | US$ 2.94 por año de tratamiento | (-98) |
| Tailandia | 2008 | Docetaxel | US$900 | US$37 | US$863 | (-96) |
| Tailandia | 2008 | Letrozol | US$7 | US$0.1 | US$0.9 | (-99) |
| Brasil | 2007 | Efavirenz | US$580 por año de tratamiento | US$163.22/166.36 por año por paciente | Entre US$416,78 y 413.64 por año paciente | (-72;- 71) |
| Ecuador | 2010 | Lopinavir/ Ritonavir | US$289.99 por frasco de 30 cápsulas | US$29.40 por frasco de 30 cápsulas | US$260.59 por frasco de 30 cápsulas | (-90) |
| Ecuador | 2014 | Etoricoxib | US$0.84 por tableta | US$0.084 por tableta | US$0.83 por tableta | (-99) |
| India | 2012 | Sorafenib | US$5.500 por mes | US$175 por mes | US$5.325 por mes | (-97) |
Fuente: Tomado de South Centre, 2023(25)
4.2.1.2. Del respeto y garantía de las obligaciones internacionales
Que algunos de los comentarios recibidos al informe de recomendaciones del Comité Técnico Interinstitucional, advierten el posible incumplimiento de las obligaciones internacionales que Colombia ha adquirido con Estados Unidos, Japón y Reino Unido en los Tratados de Libre Comercio, así como los efectos de la inseguridad jurídica que se causará por la expedición de la Licencia Obligatoria.
Que al respecto, se debe indicar que esta situación fue objeto de análisis por parte de este Ministerio, previo a la apertura del procedimiento realizada en la Resolución 881 del 2 de junio de 2023, pues se estudió de manera detallada el marco jurídico de la declaratoria de interés público con fines de licencia obligatoria, establecido en el Acuerdo sobre los ADPIC, los tratados internacionales vigentes, la Decisión 486 de 2000 y la normatividad interna.
Que además, esta situación fue revisada por parte de los miembros del Comité en el trámite de elaboración, como quedó consignado en el documento de recomendaciones.
Que asimismo, el profesor Óscar Lizarazo(26), en la observación allegada a este Ministerio(27), hizo un análisis de esta situación y concluyó lo siguiente:
“Es inapropiado hacer una lectura aislada no sistemática del TLC. Las garantías a la propiedad intelectual, y a la inversión, están acompañadas de salvedades que no deben perderse de vista.
De un lado artículos como el 10.7 del TLC protegen la inversión, Art 8.38 (sic), pero el protocolo modificatorio del TLC Ley 1166 de 2007 incluye matices relevantes, de hecho, menciona explícitamente el VIH.
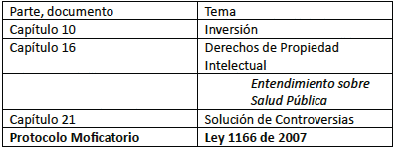
No es de buena fe, o cuando menos no es apropiado, citar el texto inicial del TLC entre Colombia y EE. UU., sin considerar el texto vigente, modificado y actualizado por el protocolo modificatorio, como al parecer hacen los apoderados de algunas empresas. Tampoco es apropiado interpretar aisladamente los capítulos 10, 16 y 21 (iniciales), sin tener en cuenta el “entendimiento sobre salud pública” y el protocolo modificatorio.
Además, en cuanto a reglas de interpretación el capítulo 10 de inversión dice que prevalecen otros capítulos:
“Artículo 10.2. Relación con Otros Capítulos
1. En el caso de existir cualquier incompatibilidad entre este Capítulo y otro Capítulo, el otro Capítulo prevalecerá en la medida de la incompatibilidad”.
Pero incluso el propio capítulo 10 dice que no hay expropiación directa ni indirecta cuando se da una licencia obligatoria conforme con ADPIC:
Art. 10.7.5 Este artículo no se aplica a la expedición de licencias obligatorias otorgadas con relación a derechos de propiedad intelectual conforme con el Acuerdo ADPIC, o a la revocación, limitación o creación de derechos de propiedad intelectual en la medida que dicha expedición, revocación, limitación o creación sea compatible con el Capítulo Dieciséis (Derechos de Propiedad Intelectual).
En particular es muy relevante para el caso el capítulo 16 actualizado, corregido por el protocolo modificatorio, menciona explícitamente VIH, y tuberculosis. La tuberculosis suele afectar a pacientes con VIH.
“Artículo 16.13. Entendimientos sobre ciertas medidas de Salud Pública 1. Las Partes afirman su compromiso con la Declaración Relativa al Acuerdo sobre los ADPIC y la Salud Pública (WT/MIN(01)/DEC/2).
2. Las Partes han llegado a los siguientes entendimientos con respecto al presente Capítulo:
(a) Las obligaciones del presente Capítulo no impiden, ni deben impedir, que una Parte tome las medidas necesarias para proteger la salud pública mediante la promoción del acceso a medicamentos para todos, en particular los casos relativos al VIH/SIDA, la tuberculosis, el paludismo y otras epidemias, así como situaciones de suma urgencia o de emergencia nacional. En consecuencia, al tiempo que las Partes reiteran su compromiso con el presente Capítulo, afirman que este puede y debe ser interpretado y aplicado de una manera que apoye el derecho de cada una de las Partes de proteger la salud pública y, en particular, de promover el acceso a los medicamentos para todos;
(b) En reconocimiento del compromiso de acceso a los medicamentos suministrados conforme a la Decisión del Consejo General tomada el 30 de agosto de 2003 sobre la Implementación del Párrafo Seis de la Declaración de Doha relacionada con el Acuerdo sobre los ADPIC y la Salud Pública (WT/L/540) y de la Declaración del Presidente del Consejo General de la OMC que acompañan la Decisión (JOB(03)/177, WT/GC/M/82) (colectivamente, la “Solución ADPIC/Salud”), el presente Capítulo no impide, ni debe impedir, la utilización efectiva de la Solución ADPIC/Salud;
(c) Con respecto a los asuntos mencionados, si una enmienda al Acuerdo ADPIC entra en vigor con respecto a las Partes y la aplicación de una medida por una Parte de conformidad con dicha enmienda infringe el presente Capítulo, las Partes consultarán inmediatamente para adaptar este Capítulo según convenga a la luz de la enmienda”.
Tampoco es apropiado el uso “político” o para generar presión de los mecanismos de solución de controversias, ISDS o arbitraje de inversión”.
Que con fundamento en lo anterior, se concluye que el Procedimiento de declaratoria de interés público medicamentos cuyo principio activo es el Dolutegravir con fines de licencia obligatoria, iniciado, de oficio por el Ministerio de Salud y Protección Social, ha sido adelantado en el marco de la soberanía nacional, con estricto cumplimiento de la normatividad nacional e internacional vigente, y garantizando plenamente el debido proceso. En consecuencia, se hace evidente que Colombia no ha incumplido ninguna de las obligaciones internacionales que el país ha asumido.
4.2.3.1. De la ausencia de afectación a la innovación e inversión en el país.
Que a su vez, algunos intervinientes señalan que estas licencias causan desmedro en la inversión realizada por quien desarrolla los fármacos, con lo que no se permite el retorno de la inversión en investigación y desarrollo, evento que podría desincentivar la innovación en el país.
Que al respecto, es necesario precisar que la misma normatividad vigente establece los mecanismos de flexibilidades del sistema de patentes que, en supuestos excepcionales, permite limitar temporalmente el alcance de los derechos exclusivos del titular de la patente para autorizar la producción industrial o el uso de la invención patentada por parte de terceros(28).
Que en este aspecto, es importante resaltar que las licencias obligatorias deben cumplir algunos requisitos adicionales. En particular, no pueden otorgarse en exclusiva a los licenciatarios (es decir, el titular de la patente puede continuar la producción), y normalmente deben concederse principalmente para abastecer el mercado interno(29). De hecho, el Acuerdo sobre los ADPIC permite las licencias obligatorias como parte del objetivo general del Acuerdo de establecer un equilibrio entre la promoción del acceso a los medicamentos existentes y el fomento de la investigación y el desarrollo de nuevos medicamentos(30).
Que en este sentido ONUSIDA señala que “(…) estas opciones de políticas y otras flexibilidades pueden contribuir, directa o indirectamente, a incrementar el suministro y la disponibilidad de los medicamentos necesarios, permitiendo que los países con ingresos bajos y medios alcancen un equilibrio entre la protección de la propiedad intelectual y prioridades específicas de desarrollo como la consecución de los objetivos nacionales en materia de salud pública”(31) (Subrayado fuera del texto original).
Que ello permite comprender que el objetivo de las flexibilidades en materia de propiedad intelectual, específicamente en productos farmacéuticos, es buscar un equilibrio entre el sistema de patentes y la salud pública, logrando de esta manera que la innovación esté al servicio de la humanidad y no atienda únicamente a intereses económicos.
Que si bien, se reconoce que “los derechos de propiedad intelectual constituyen un incentivo importante para desarrollar nuevos productos de salud”, lo cierto es que su protección y cumplimiento debe tener en cuenta tanto los intereses del titular de los derechos de propiedad como los intereses del consumidor”(32). Es por esto que la observancia de los derechos de la propiedad intelectual deberán contribuir a un beneficio recíproco de los productores y de los usuarios(33).
Que concretamente “en la Declaración Política de 2021 de la Reunión de Alto Nivel de la Asamblea General de las Naciones Unidas sobre el SIDA, los países se han comprometido a hacer uso de las flexibilidades del ADPIC específicamente orientadas a promover el acceso a los medicamentos”(34).
Que conforme con lo expuesto se concluye que contrario a las afirmaciones realizadas, “no existe evidencia que concluya que las licencias obligatorias perjudiquen los incentivos para innovar”(35) (Subrayado fuera del texto original). Por el contrario, se evidencia que en experiencia internacional, en países como Alemania, al otorgarse una licencia obligatoria en 2016 para el medicamento antirretroviral raltegravir(36), la innovación no se vio afectada.(37) Tampoco fue así en el caso de Israel (2020), país líder en innovación que declaró rápidamente licencia obligatoria(38) para Ritonavir cuando se creía que dicho antiviral para el virus del VIH también podría ser útil para el virus SARS-COV2 causante del COVID.
Que con fundamento en los argumentos expuestos, se desestimarán las afirmaciones de los intervinientes, por cuanto no se encuentra plenamente acreditado que pueda existir afectación a la innovación e inversión ante una eventual declaratoria de interés público en este caso.
4.2.1.4. De la correcta interpretación de la situación actual del VIH en Colombia y la lectura del informe de la cascada
Que en este punto, es importante reiterar que en el informe de recomendaciones se incluyó la información disponible y publicada sobre la situación del VIH en Colombia por el Instituto Nacional de Salud (INS) y la Cuenta de Alto Costo (CAC).
Que allí se indicó que la CAC publicó el informe “Situación del VIH en Colombia 2022”, con la información de las cohortes para el período 1 de febrero 2021 a 31 de enero de 2022 porque aún no ha publicado el informe del año 2023, correspondiente al periodo febrero 2022 a enero 2023.
Que en relación a las estimaciones obtenidas, el mencionado documento hace referencia a los resultados obtenidos en el software de Spectrum y los cálculos correspondientes a la cascada de la atención, la cual se mide sobre el total de la población estimada.
Que en este caso el software Spectrum estimó que para el año 2021 un total de 183.356 personas viviendo con VIH de las cuales a la CAC en el periodo 1 de febrero de 2021 a 31 de enero de 2022 se reportaron:
- 141.787 personas que conocían su diagnóstico de VIH, es decir, 77,3% del total de personas estimadas viviendo con VIH.
- 125.264 personas recibiendo tratamiento ARV, es decir, 68,3% del total de personas estimadas viviendo con VIH.
- 109.730 personas con carga viral suprimida, es decir, 59,8% del total de personas estimadas viviendo con VIH.
Que cuando esta misma información se utiliza para calcular los avances frente a las metas 95-95-95 para el mismo periodo del reporte, arroja que los resultados son los siguientes:
- 141.787 personas que conocían su diagnóstico de VIH, es decir, 77,3% del total de personas estimadas viviendo con VIH, primer 95.
- 125.264 personas recibiendo tratamiento ARV, es decir, 88,3% del total de personas que conocían su diagnóstico, segundo 95.
- 109.730 personas con carga viral suprimida, es decir, 87,6% del total de personas recibiendo tratamiento ARV, tercer 95.
Que estos datos demuestran porque para un mismo periodo los porcentajes varían de acuerdo con el tipo de medición que se esté realizando, o bien porque corresponden a cascada de la atención o bien al reporte sobre las metas 95-95-95.
Ahora bien, si lo que se quiere es comparar los resultados de los últimos dos años de la información disponible, en el informe de recomendaciones se encuentran las tablas publicadas en el informe de la situación del VIH en Colombia 2022, que muestran los resultados de los periodos 1 de febrero de 2020 a 31 de enero de 2021 y 1 de febrero de 2021 a 31 de enero de 2022, demostrando que, el número de personas con carga viral suprimida pasó de 85,67% a 87,60%, y de aquellos con carga viral indetectable pasó de 76,9% a 78,1%. Sin embargo, si estas estadísticas se calculan sólo para las personas retenidas en la atención, el porcentaje de personas con carga viral suprimida descendió de 90,58% a 89,94%, y de aquellos con carga viral indetectable descendió de 81,73% a 80,52% en el último periodo reportado.
Es importante tener en cuenta que aunque la información contenida en el Informe de recomendaciones aclara que se incluye casos de personas diagnosticadas con infección de larga data, ello se debe a que tienen un nuevo diagnóstico, de forma que el número absoluto de casos ha presentado un incremento significativo de 32,5%, pasando de 14.474 casos en 2018 a 19.183 casos en 2022(39). Este valor es 4 veces mayor que el estimado para América Latina, que es de 8% de aumento entre 2010 a 2022, con aproximadamente 110.000 nuevas infecciones en 2021(40).
Que por otro lado, la prevalencia reportada en el estudio Bienvenir (0,9%), al ser comparada con la prevalencia estimada en la población general colombiana (0,5%), muestra que dicha prevalencia es casi el doble de la prevalencia en personas nacionales, lo cual, sumado a que la prevalencia en Barranquilla y Soledad es mayor al 1% en población general venezolana, significa que, en esta población, se estaría presentando una epidemia generalizada(41). Por tanto, es urgente para el país garantizar la atención de esta población, si se quiere evitar un impacto mayor en el comportamiento de la epidemia, tanto entre la población migrante como en la población colombiana, teniendo en cuenta que, de acuerdo con las definiciones de la OMS, este nivel de prevalencia es suficiente para la expansión de la epidemia en la población general(42).
Que todo ello permite ver que existe un número significativo de las personas que viven con VIH en Colombia que pertenecen a poblaciones clave, algunas de ellas con prevalencias mayores al 5%, por lo cual Colombia se clasifica como una epidemia concentrada(43).
Que por lo mencionado, se estima que el Informe de Recomendaciones sí contiene evidencia acerca de la urgencia de atender la población afectada y de incluir el medicamento recomendado por la OMS para la atención de primera y segunda línea.
4.2.1.5. Del test de razonabilidad en el Informe del Comité Técnico Interinstitucional
Que el informe de recomendaciones incluyó la tabla denominada “Resultados test de razonabilidad”, a través de la cual aplicó la metodología que, de acuerdo con el Tribunal Andino de Justicia, en su interpretación prejudicial 144 IP-2023, debe ser aplicada para efectos de justificar una medida de declaratoria de razones de interés público para el otorgamiento de licencias obligatorias.
Que, a pesar de ello, se recibieron algunos comentarios dirigidos a discutir el análisis realizado por el Comité.
Que en relación a estos, el Ministerio de Salud y Protección Social exploró en el documento de recomendaciones, encontrando medidas alternativas para atender de forma efectiva la situación de salud pública generada a raíz de la infección por VIH, para hacerle frente a la situación epidemiológica del país y de esta mantener el control de la epidemia.
Que es así como uno de los objetivos de la licencia obligatoria es garantizar que las Personas que viven con VIH reciban el Dolutegravir como la mejor opción de tratamiento sugerida por la OMS de acuerdo con las Guías de Práctica Clínica vigentes, pues, aunque la utilización de Dolutegravir va en aumento, no está ocurriendo a una velocidad que permita atender, a las personas de los grupos objetivo considerados en el análisis publicado en el informe de recomendaciones, los cuales según la evidencia requieren tener acceso a Dolutegravir y de esta manera acelerar y garantizar el cumplimiento oportuno de la meta 95-95-95, como uno de los objetivos de desarrollo sostenible y en consecuencia tener un mayor impacto en el comportamiento de la epidemia a nivel nacional, protegiendo de esta forma la salud de los residentes en el país.
Que en suma a lo dicho, se tiene que contrario a lo expresado por los observantes, no existe una falla argumentativa en el documento de recomendaciones, en tanto que el contenido de los documentos del estudio Bienvenir y el informe de ONUSIDA, no es contradictorio al uso de una licencia obligatoria en la modalidad de uso gubernamental, pues tal como se ha reiterado, Colombia está aplicando diferentes medidas para atender a las personas con VIH y se ha evidenciado que se requiere del uso de esta licencia obligatoria en la modalidad de uso gubernamental, como una herramienta subsidiaria para cumplir con los fines del Estado.
Que de esta manera se habilitaría legalmente la disponibilidad del medicamento genérico del Dolutegravir en una cantidad suficiente para atender a las personas de los grupos objetivo considerados en este análisis, los cuales se reitera, requieren tener acceso al tratamiento recomendado como primera opción por la OMS y la GPC de Colombia.
Que este análisis se fortalece al revisar la observación recibida al documento de recomendaciones por el Programa Conjunto para el VIH/sida - ONUSIDA, en la que indica que “esta licencia obligatoria eliminaría una de las principales barreras de acceso a tratamiento de primera línea del VIH en Colombia, y contribuirá a alcanzar las metas globales de prevención y tratamiento del VIH de la Estrategia Global de SIDA 2021-2026 (metas 95-95-95), para terminar con el SIDA como un problema de salud pública para 2030 y cumplir con el Objetivo de Desarrollo Sostenible (3.3). Esto en el marco de la adhesión de Colombia a la Declaración Política sobre el VIH y el SIDA 2021 de la Asamblea General de las Naciones Unidas: Acabar con las desigualdades para poner fin al SIDA para 2030”.
Que tampoco se evidencian errores en el juicio de necesidad realizado por el Comité Técnico Interinstitucional porque actualmente no existen medios alternativos igualmente adecuados para la obtención del fin pretendido pero menos restrictivos de los derechos afectados, esto en razón a que, el estado ha estado realizando todas las acciones para controlar la epidemia de VIH y al ser el Dolutegravir el medicamento de primera línea recomendado por la OMS y la GPC Colombiana, no existe otro medio adecuado para complementar la atención a la población de personas viviendo con VIH, lo cual permite dar cumplimiento del mandato constitucional establecido en el artículo 49 de la Constitución Política de Colombia y la Ley 1751 de 2015, relacionado con la protección de la salud individual y colectiva de la población. Menos aun cuando, como ya se ha insistido, el Ministerio ya realizó múltiples acciones y consideró varias alternativas para no afectar los derechos de propiedad intelectual de los titulares de las patentes, no obstante, no hubo respuesta satisfactoria al respecto por parte de este.
Que por último, en lo relacionado con el juicio de proporcionalidad, es evidente que para lograr el fin de salud pública que se busca, es necesaria la licencia obligatoria en la modalidad de uso gubernamental, en tanto que se suma a las medidas actuales, al habilitar la importación y disponibilidad del medicamento genérico, que permitiría poner a disposición el tratamiento recomendado a i) población migrante venezolana (regular e irregular); ii) personas que viven con VIH recién diagnosticadas; iii) personas con falla virológica; iv) personas que requieren profilaxis post exposición que según la evidencia y análisis presentados por el MSPS requerirían en primera medida el Dolutegravir y de esta forma evitar un impacto mayor en el comportamiento de la epidemia a nivel nacional.
Que así, se evidencia que el test realizado por el Comité busca proteger la salud pública individual y colectiva de los residentes en Colombia, a través de la concesión de la licencia obligatoria en modalidad de uso gubernamental, expedida por la Superintendencia de Industria y Comercio, sobre los derechos de patente del Dolutegravir, en cumplimiento a lo establecido en el artículo 2.2.2.24.7. del Decreto 1074 de 2015, en la cual se determinará la compensación económica para el titular de la patente, respetando su derecho de seguir explotándola de acuerdo con lo establecido en la Decisión 486 de 2000.
4.2.2. Consideraciones específicas a las observaciones presentadas
4.2.2.1 Daniel Hernández
Que teniendo en cuenta que se trata de una posición subjetiva frente a una eventual declaratoria de interés público, el Ministerio de Salud y Protección Social no realizará ningún tipo de pronunciamiento de fondo al respecto.
4.2.2.2. Asociación Colombiana de la Propiedad Intelectual (ACPI)
Que en cuanto a la advertencia que se realiza frente a un eventual riesgo por el uso indiscriminado de licencias obligatorias y el presunto desconocimiento de la legislación en materia de propiedad intelectual, debe indicarse que, de acuerdo con los estudios académicos actuales, para este Ministerio la declaratoria de interés público que se está adelantando, “trasciende el marco específico de la propiedad intelectual para ubicarse dentro de la jerarquía de derechos, cuyo faro y guía es el derecho internacional de los derechos humanos, y entre ellos el derecho fundamental a la salud”(44).
Al respecto, Martín Uribe Arbeláez en el documento de consulta pública denominado Impatentabilidad de Medicamentos esenciales, ha señalado lo siguiente(45):
“(…) Esta hermenéutica es la adoptada por la Declaración de Doha al darle prelación, preferencia y preeminencia a la salud por encima de cualquier tipo de derechos de propiedad intelectual. Hacer énfasis en las flexibilidades del ADPIC: licencias obligatorias, importaciones paralelas, entre otras, es recordar que hay mecanismos legales aceptados por la OMC (Organización Mundial de Comercio) para hacer frente a las necesidades de salud pública, y que implementarlos depende de la voluntad política de los gobiernos para salvaguardar la salud de sus pueblos”.
“En esta misma línea discursiva hay que caracterizar los medicamentos esenciales como un bien de interés público, y ser consecuentes con esta calificación o categorización: si, de conformidad con el derecho internacional de los derechos humanos, la salud es un derecho fundamental que debe ser protegido por los Estados signatarios, hay que facilitar el acceso a los fármacos, lo que no se consigue al permitir su patentabilidad, que implica un monopolio que excluye la competencia e inhibe el desarrollo de otros medicamentos que cumplan la misma finalidad terapéutica” (negrilla fuera del texto original).
Que de acuerdo con ello, se comprende que el derecho fundamental a la salud implica el acceso a los medicamentos para que cumplan con su finalidad de salvar vidas, curar o tratar enfermedades. Por eso es que son bienes públicos, como se desprende del derecho internacional de los derechos humanos, la reiterada costumbre internacional manifiesta en el listado de medicamentos esenciales, doctrina internacional, bloque de constitucionalidad y jurisprudencia constitucional.(46)
Que en la Declaración Ministerial principal adoptada en Doha el 14 de noviembre de 2001, los gobiernos de los Miembros de la OMC pusieron de relieve la importancia de aplicar e interpretar el Acuerdo sobre los ADPIC de manera que permitiese apoyar la salud pública promoviendo tanto el acceso a los medicamentos existentes como la creación de otros nuevos(47). En ella convinieron en que el Acuerdo sobre los ADPIC no podía y no debía impedir que los Miembros adoptaran medidas con objeto de proteger la salud pública. Subrayan asimismo la capacidad de los países de hacer uso de la flexibilidad prevista en el Acuerdo sobre los ADPIC, en particular las licencias obligatorias y las importaciones paralelas.
Que desde el Gobierno nacional se reconoce la importancia de la propiedad intelectual y el respeto a las instituciones existentes, por esto el procedimiento que se está adelantando, se realiza en el marco de la soberanía nacional, dando estricto cumplimiento a lo establecido en el Acuerdo sobre los Aspectos de los Derechos de Propiedad Intelectual relacionados con el Comercio (ADPIC), contenido en el Anexo 1C del Acuerdo de Marrakech, por el que se establece la Organización Mundial del Comercio (OMC), la Decisión 486 de 2000 sobre el Régimen Común sobre Propiedad Industrial de la Comisión de la Comunidad Andina y el capítulo 24 del Decreto 1074 de 2015 único reglamentario del sector comercio, industria y turismo.
4.2.2.3. Asociación Colombiana de Infectología - Ernesto Martínez
Que conforme a sus observaciones, se debe informar que el Ministerio de Salud y Protección Social ha realizado diferentes estrategias para lograr el acceso real del Dolutegravir a la población que vive con VIH, de conformidad con lo previsto en la “Guía de Práctica Clínica (GPC) basada en la evidencia científica para la atención de la infección por VIH/SIDA en personas adultas, gestantes y adolescentes”.
Que entre las estrategias, se encuentra el acercamiento con los titulares de las patentes, situación que fue expuesta en el numeral 4.5.3 del documento de recomendaciones publicado por el Comité Interinstitucional. Allí se detalló que el Ministerio de Salud y Protección Social el 18 de octubre de 2022, previo a la expedición de la Resolución 881 de 2023, buscó explorar alternativas que permitieran la obtención de los medicamentos necesarios para atender a la población.
Que dicha solicitud, tal como se narra en el documento y como se reforzará más adelante, derivó en una comunicación vía correo electrónico de este Ministerio a ViiV Healthcare y GlaxoSmithKline Colombia S. A. de venta del medicamento a los precios de referencia de Wambo, en la cual se solicita realizar la donación del medicamento para atender a la población migrante o de proponer cualquier otra alternativa que pueda generar la atención de la población migrante con VIH.
Que a pesar de esto, esta petición fue respondida el 6 de diciembre de 2022 de forma negativa por parte de ViiV Healthcare. Pese a la urgencia señalada por este Ministerio, hasta el día de hoy ViiV no ha realizado ninguna propuesta para atender esta población.
Que debido a la necesidad, con el fin de buscar todas las opciones posibles, el 24 de febrero de 2023, el Ministerio de Salud y Protección Social mantuvo conversaciones con el Medicines Patent Pool (MPP), en las que se revisó la opción de que Colombia fuese incluida en la licencia voluntaria existente para el DTG de uso adulto, pero en dicha reunión el MPP manifestó que el país NO es un país de ingresos bajos y por lo tanto NO es beneficiario de la licencia voluntaria para la presentación para uso en adultos.
Que lo anterior denota que sí se han realizado acercamientos y se han buscado alternativas previas a la presente declaratoria de interés público, siempre en procura atender la problemática en salud pública generada por la infección del VIH, especialmente, en las poblaciones más vulnerables. Todo esto a pesar de que, de conformidad con lo establecido en el literal b) del artículo 31 del Anexo IC de los Acuerdos sobre los ADPIC, cuando se requiere el uso de una patente para fines de uso público no comercial sin autorización del titular de los derechos, no es obligatorio intentar previamente obtener la autorización del titular de la patente, así como tampoco realizar otras alternativas como la compra centralizada.
Que concretamente señala esta norma, lo siguiente:
“b) Sólo podrán permitirse esos usos cuando, antes de hacerlos, el potencial usuario haya intentado obtener la autorización del titular de los derechos en términos y condiciones comerciales razonables y esos intentos no hayan surtido efecto en un plazo prudencial. Los Miembros podrán eximir de esta obligación en caso de emergencia nacional o en otras circunstancias de extrema urgencia, o en los casos de uso público no comercial. Sin embargo, en las situaciones de emergencia nacional o en otras circunstancias de extrema urgencia el titular de los derechos será notificado en cuanto sea razonablemente posible. En el caso de uso público no comercial, cuando el Gobierno o el contratista, sin hacer una búsqueda de patentes, sepa o tenga motivos demostrables para saber que una patente válida es o será utilizada por o para el Gobierno, se informará sin demora al titular de los derechos”.
Que por lo mencionado, se debe aclarar que esta declaratoria de interés público busca un equilibrio entre el sistema de patentes y la salud pública, logrando de esta manera que la innovación esté al servicio de las personas para garantizar el derecho a la salud de quienes viven con VIH en Colombia.
4.2.2.4 Asociación de Laboratorios Farmacéuticos de Investigación y Desarrollo (Afidro)
Que frente a su afirmación de que la licencia obligatoria habilitaría legalmente la importación, y la disponibilidad del medicamento genérico Dolutegravir para el tratamiento de los grupos de población objetivo que de acuerdo con la información presentada previamente tienen problemas de acceso al tratamiento, este Ministerio resalta que dicha importación del medicamento genérico no sería viable jurídicamente sin la licencia obligatoria, a menos que mediara la autorización del titular de la patente, cuya negociación fracasó de acuerdo con la información suministrada por el MSPS.
Que por lo anterior y conforme se ha mencionado a lo largo de las consideraciones de este acto administrativo, es viable continuar con el análisis de declaratoria de existencia de razones de interés público para someter una patente de los medicamentos cuyo principio activo es el Dolutegravir a licencia obligatoria en la modalidad de uso gubernamental.
Que en cuanto a la existencia de otras alternativas terapéuticas, es preciso indicar que en el numeral 4.5 del documento de recomendaciones se exploraron alternativas previas para atender la situación de interés público. Allí se mencionan las medidas que se han realizado para aumentar la cobertura diagnóstica en el país. Por otra parte, reconociendo que se deben fortalecer al mismo tiempo las acciones de prevención del VIH, en mayo de 2023 Colombia se adhirió a la coalición mundial por la prevención del VIH, bajo la cual, actualmente se está estructurando un plan de fortalecimiento de las acciones de prevención, teniendo como punto de partida el “Plan Nacional de Respuesta ante las ITS, el VIH, la coinfección TB/VIH y las hepatitis B y C, Colombia 2022-2025”.
Que las demás observaciones fueron resueltas a través de las consideraciones de esta resolución.
4.2.2.5 AMIIF - Asociación Mexicana de Industrias
Que en atención a los argumentos expuestos, encuentra este Ministerio que si bien de acuerdo con el informe publicado, la tendencia de Dolutegravir muestra un aumento en su prescripción, lo mismo no refleja la potencial demanda insatisfecha que se tiene del producto en la actualidad.
Que frente a esta limitación, y como se mencionó en el apartado “4.4.1. Acceso al tratamiento antirretroviral en Colombia” del informe de recomendaciones allegado por el Comité, desde el monitoreo de abastecimiento de medicamentos que realiza el Ministerio de Salud y Protección Social se ha identificado un incremento en la frecuencia de reportes de problemas de disponibilidad de algunos antirretrovirales, siendo esta información obtenida del reporte realizado por Gestores Farmacéuticos.
Que dado que en los reportes de gestores farmacéuticos no se encontró información específica sobre el Dolutegravir, se indagó en los reportes realizados durante el 2023 por parte de las EPS las cuales han tenido una participación más activa desde el segundo trimestre del año 2023, encontrando un incremento en el número de reportes para Dolutegravir representado un 10,88% del total de reportes recibidos y su combinación con lamivudina y abacavir representando un 9,52%.
Gráfica 1. Frecuencia en porcentaje del total de reportes recibidos por medicamentos empleados como antirretrovirales desde abril 2023 hasta septiembre 2023
Que al detallar las zonas geográficas afectadas por los problemas de disponibilidad, se encuentra una afectación en general en el país, siendo concentrada en los departamentos del Valle del Cauca, Cundinamarca y en la ciudad de Bogotá D. C.
Gráfica 2.

Que complementario a lo anterior, al verificar las causas asociadas a la escasez de estos productos, se tienen como principales causas los problemas logísticos (47,29%), la disminución de la oferta (28,88%) y la entrega incompleta (16,97%).
Gráfica 3. Causas asociadas a la escasez de medicamentos antirretrovirales por parte de EPS
Que al detallar las causas asociadas a la escasez del Dolutegravir, las EPS reportantes señalan como la principal causa la disminución de la oferta con un 96,55%, lo cual permite inferir que la oferta disponible no está atendiendo de forma satisfactoria la demanda del medicamento.
Gráfica 4. Causas asociadas a la escasez de Dolutegravir por parte de EPS
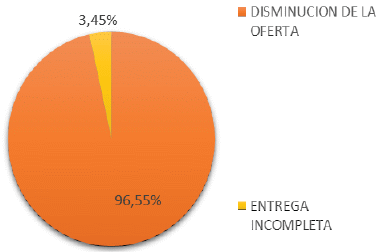
Que la anterior información resulta relevante teniendo en cuenta que las EPS son las responsables de organizar y garantizar, directa o indirectamente, la prestación del plan de beneficios en salud a los afiliados(48), el acceso efectivo y oportuno a los servicios y tecnologías de salud, y por tanto son las competentes para adelantar los procesos de contratación de tecnologías en salud para garantizar su disponibilidad.
Que por lo mencionado, es claro que, aunque se tenga un aparente incremento en la prescripción y comercialización del Dolutegravir, lo mismo no se traduce en un suministro efectivo del mismo ya que como se observaba con la información antes presentada, se tienen dificultades en la disponibilidad de este medicamento, situación que de no ser atendida puede agravarse teniendo en cuenta las dificultades mostradas en el abastecimiento de los medicamentos que actualmente se usan mayoritariamente.
4.2.2.6. Cavelier Abogados - Viiv Healthcare Company, Shionogi & Co., Ltd y Glaxosmithkline Colombia S. A.
Que en relación con las observaciones al trámite de declaratoria y el informe de recomendaciones por presuntas fallas procedimentales y de fondo, se aclara que el correo electrónico de fecha 6 de septiembre de 2023 se remitió con fines informativos para poner en conocimiento de los interesados que la publicación del informe de recomendaciones del Comité Interinstitucional se surtió el 5 de septiembre de 2023 en la página web del Ministerio Salud y Protección Social, por lo cual no es correcto afirmar que se trató de una notificación del informe, más aún si se tiene en cuenta que el parágrafo 5 del artículo 2.2.2.24.6 del Decreto 1074 de 2015 no dispone aquella figura jurídica.(49)
Que de acuerdo con el mencionado parágrafo el Comité debió poner a disposición de los interesados y autoridades públicas pertinentes, el informe de recomendación y no otra documentación adicional, por lo cual no es correcto afirmar que el informe fue “informado a los terceros interesados de manera incompleta, pues no incluyó piezas procesales y probatorias en las que el mismo documento hace referencia expresa”.
Que a pesar de no ser un deber previsto en el Decreto 1074 de 2015 para la contradicción del informe, el Comité sí remitió los documentos que fueren solicitados, ello para garantizar los derechos a la publicidad, transparencia y derecho de petición. Por este motivo, se evidencia del documento obrante en el plenario que el Secretario del Comité envió el concepto técnico sobre las categorías de clasificación del grado de evidencia en las recomendaciones de la GPC del Instituto de Evaluación Tecnológica en Salud (IETS) y las actas de sesión requeridas.
Que adicionalmente, las solicitudes de suspensión presentadas fueron resueltas tanto en el marco de las actuaciones del Comité como las actuaciones adelantadas por este Ministerio en el procedimiento administrativo de declaratoria de existencia de razones de interés público encontrando cada una de ellas improcedentes de acuerdo con el marco normativo vigente.
Que por lo anterior, ni el Comité ni el Ministerio podían ampliar los términos que fueron previstos por el legislador.
Que en cualquier caso, se evidencia que aquellos documentos de consulta pública que fueron referenciados por el Comité en el Informe, cuentan con los enlaces señalados en la numeración de pie de página del documento, es decir, el interesado podía válidamente acceder a cada uno de ellos, veamos a modo de ejemplo:

Que por otro lado, tampoco era necesario que las solicitudes probatorias fueran resueltas por este Ministerio antes de que el Comité emitiera el informe de recomendaciones porque a la luz del artículo 2.2.2.24.6 del Decreto 1074 de 2015, el Comité tenía la facultad de examinar los documentos que se pusieron a su disposición y solicitar la información adicional o complementaria requerida, sin que debiera mediar solicitud probatoria de la autoridad competente, pues las actuaciones que se realizan en el marco del Comité Técnico Interinstitucional son autónomas a las que debe adoptar esta cartera ministerial para adoptar la decisión de fondo.
Que en lo que toca a la fe de erratas emitida por el Comité, no se evidencia vulneración a los derechos de los intervinientes por cuanto la situación fue aclarada por este Ministerio a través del Auto número 003 de 2023 y el informe tuvo en cuenta cada una de las observaciones presentadas con ocasión al inicio de esta actuación administrativa a través de la Resolución número 881 de 2023.
Que en cuanto a la afirmación relacionada con el porcentaje de ahorro y no en el impacto efectivo de dicha licencia obligatoria para el acceso al medicamento por un número mayor de pacientes, se precisa que el estudio de South Centre(50) ha demostrado que el uso de licencias obligatorias tiene repercusiones inmediatas en términos de acceso asequible, ya que las reducciones de precios obtenidas como consecuencia posibilitaron ampliar la cobertura poblacional brindada con los recursos presupuestarios estatales existentes. Por ejemplo, en el caso de Malasia el número de pacientes tratados en servicios públicos aumentó de 1.500 a 4.000 (Maybarduk, 2014). Este tipo de medidas buscan generar mejores condiciones para la accesibilidad de los tratamientos requeridos.
Que en que toca al uso del Dolutegravir como medida para cumplir el objetivo 95- 95-95 y la autonomía del médico tratante, tiene razón el interviniente cuando afirma que la elección del tratamiento puede depender de muchas variables y es el médico tratante quien en su autonomía define el mejor tratamiento de acuerdo con el perfil del paciente. Sin embargo, se recuerda que la elección debe ser adoptada a través de herramientas que permiten guiar a los médicos en la elección de los tratamientos idóneos, como lo son la evidencia disponible y las guías de práctica clínica, para el caso de Colombia la “Guía de Práctica Clínica (GPC) basada en la evidencia científica para la atención de la infección por VIH/SIDA en personas adultas, gestantes y adolescentes”, la cual recomienda como preferidos los esquemas basados en Dolutegravir en razón a que este principio activo mostró superioridad en términos de efectividad y seguridad, comparado con los demás antirretrovirales.
Que aunque se reconoce que los tratamientos basados en Dolutegravir no son la única alternativa terapéutica disponible, son precisamente los regímenes basados en este principio activo los que se consideran preferidos para el tratamiento en personas con edad igual o mayor a 18 años con diagnóstico de infección por VIH sin experiencia previa con antirretrovirales (Recomendación 12 GPC colombiana), y en tal sentido, es la razón por la que con la declaratoria de interés público de este medicamento se busca garantizar el acceso a la población a la mejor alternativa disponible.
Que esta afirmación, no implica de ninguna manera que la población no pueda tener acceso a esquemas de tratamiento diferentes, pues todas las alternativas disponibles en el país son financiadas con recursos públicos asignados a la salud.
Que de otra parte, frente a la disponibilidad en Colombia del medicamento Bictegravir, el 12 de mayo de 2021 el INVIMA otorgó el registro sanitario INVIMA 2021M-0020165 para un medicamento en combinación a dosis fija, que dentro de su composición contiene el principio activo en mención.
Que el medicamento identificado como BIKTARVY® se comercializa como tableta de liberación no modificada, se encuentra compuesto por los principios activos: Bictegravir sódico 50mg/1U + Emtricitabina 200mg/1U + Tenofovir alafenamida fumarato 25mg/1U. Se puede validar que esta CDF fue considerada dentro de la evaluación de costo-efectividad realizada por el Instituto de Evaluación Tecnológica en Salud (IETS) para la mencionada Guía de Práctica Clínica a pesar de no encontrarse aún disponible en el país, y quedó en la posición número 20, la última posición de la tabla. Por lo que se siguen considerando como preferidos los regímenes basados en Dolutegravir.
Que con relación a la causa “problemas logísticos” relacionada en la página 45 del informe publicado, es necesario precisar que la misma es reportada por los gestores farmacéuticos de manera genérica ante la no claridad por parte de los titulares de registro sobre la verdadera causa asociada ante la no entrega o entrega incompleta de medicamentos.
Que respecto a la imposibilidad de la predicción del comportamiento de los distintos productos en el mercado colombiano, relacionado con el posible aumento en los problemas de disponibilidad debido a las nuevas recomendaciones (página 46), en primer lugar, se debe considerar que si bien los modelos estadísticos de pronóstico y predicción disponibles no tienen un 100% de precisión, si es posible hacer uso de estos modelos de pronóstico de demanda a partir de series de tiempo, permitiendo prever la demanda futura de un medicamento con base en un comportamiento histórico conocido, lo que ayuda a planificar la adquisición y distribución de recursos de manera más eficiente.
Que con un análisis estadístico adecuado, se pueden identificar también grupos de pacientes que podrían beneficiarse más de un medicamento en particular. Esto conduce a una atención más personalizada y efectiva.
Que se han hecho predicciones teniendo en cuenta tres factores claves: tendencias estacionales (comportamiento claro en algunos meses del año), tendencias cíclicas (patrones visibles en el largo plazo, como aumentos, disminuciones o estabilización en la demanda, que se ven de manera clara en el tiempo), ruidos aleatorio que no siguen un patrón definido y que pueden depender de factores externos (problemas de logística en las cadenas de suministro, disponibilidad de materias primas, cambios en el patrón de consumo, innovaciones técnicas, etc...). Cada uno de estas características determina o da una idea del modelo a escoger y a su vez este se valida, por ejemplo, usando solo un conjunto de datos de la información histórica y comparando las predicciones con datos reales que se tengan disponibles para saber qué tan precisos pueden ser los pronósticos sobre periodos no observados, así como la evaluación de métricas de los modelos candidatos y la optimización de parámetros.
Que ningún modelo es perfecto y por tanto, luego de que se haya revisado la calidad de la información, escogido el modelo y la evaluación de su rendimiento se deja claro que existe una incertidumbre asociada a la estimación final, por lo cual, también se generan intervalos de confianza de la estimación y se analizan en diferentes escenarios lo que sí podría estar sucediendo con alta probabilidad (patrones claros de aumentos, disminuciones o estabilizaciones de las tendencias). Probando el mismo proceso en otros tipos de medicamentos ayuda a consolidar el proceso de análisis y posible predicción para entender el comportamiento histórico y en un futuro cercano. Estos modelos estadísticos de pronóstico y predicción son aplicados por diferentes industrias con la finalidad de tener una mayor eficiencia en su actividad productiva y gestión de recursos, en donde la industria farmacéutica no es ajena al uso de estos.
Que en virtud de lo expuesto, y considerando el incremento en la frecuencia de reporte de problemas de disponibilidad de algunos antirretrovirales, sumado a la implementación de las nuevas recomendaciones para el tratamiento de primera línea del VIH, está generando un fenómeno de cambios en los patrones de prescripción que conlleva a una mayor y progresiva demanda del Dolutegravir (gráfico 8 del informe), la cual no está siendo debidamente atendida teniendo en cuenta los problemas de disponibilidad reportados recientemente por las EPS.
Que así mismo es importante aclarar que, se usa la palabra incidencia en la página 28 del Informe para referirse al reporte SIVIGILA, dado que el informe para el evento del VIH del INS la denominan: tasa de incidencia, por lo tanto, técnicamente es correcto decir que son casos reportados, porque son casos de nuevos diagnósticos de VIH que acaban de ser ingresado a los servicios de atención integral de VIH. Sin embargo, esta información contenida en el documento de recomendaciones demuestra que hay diferencia entre los 12.919 casos que la CAC indica como “incidentes” (Situación del VIH en Colombia 2022: Cohorte 01 febrero 2021 a 31 de enero de 2022), con los 17.876 casos nuevos reportados al SIVIGILA en el año 2021, deja una diferencia de personas que evidentemente no ingresaron a la CAC en el mismo año que fueron diagnosticados.
Que también se anota que aunque en los últimos 7 años haya un mejor registro y vigilancia de la condición en salud de las personas que viven con VIH, no se atribuye solamente a esto el incrementado de la tasa de reporte anual, toda vez que, que antes del año 2015 los reportes de casos de VIH de personas procedentes del exterior eran menor, ejemplo: 12 casos en 2013, 18 casos en 2014, 32 casos en 2015, y 43 en 2016 y en los últimos años han aumentado los reportes; lo anterior se da al mismo tiempo que aumentó el flujo migratorio en el país a expensas de personas que llegaron de fuera del país y que tiene permanencia o intención de residencia en Colombia de manera regular o irregular y a los cuales el estado Colombiano requiere darle una atención en salud frente a su estado positivo de VIH, en el marco al derecho a la salud de toda persona y el impacto que pueden tener la interacción de las poblaciones receptoras y migrantes en el número de casos que se reportan en el país.
Que frente a las afirmaciones enviadas por los interesados en las páginas 26 y 27 del oficio, es necesario aclarar que el documento de recomendaciones indicó que, sumada la prevalencia en la población general venezolana en Barranquilla y Soledad es mayor a 1.0%, por lo cual, se estaría presentando una epidemia generalizada; es importante aclarar que en el documento de recomendaciones en ningún momento se está diciendo que la epidemia generalizada es en la población Colombiana, está señalando específicamente la población general venezolana, de acuerdo a los resultados del estudio.
Que en cuanto la afirmación que indica que: “En este último aparte, se identifica con preocupación que el Comité en su informe, desagrega artificialmente los resultados de la evaluación económica, indicando en la página 42...”, es importante precisar que si bien en la tabla 5 del informe, denominada “Precios del tratamiento con DTG Y/O Efavirenz - SISMED 2022”, se presenta un análisis de precios de las alternativas mencionadas, las cuales son mutuamente excluyentes, esto no quiere decir que sea un análisis unidimensional, ya que se tuvieron en cuenta aspectos como la calidad de vida de los pacientes, eventos adversos y adherencia al tratamiento, tal como lo menciona la GPC.
Que así en el informe se muestra información de costo efectividad de la GPC basada en la evidencia científica para la atención de la infección por VIH/SIDA en personas adultas, gestantes y adolescentes “(2021), donde se analizaron los costos y la efectividad de los esquemas de terapia antirretroviral (TAR). Allí se puede ver que en términos de costos totales la estrategia con EFV, si bien en costo de medicamento tiene una participación aproximada del 20% frente a las otras alternativas, también se muestra una mayor participación en costos del seguimiento (80% aprox.) frente a las estrategias que contiene DTG (figura 9 evaluación económica de la GPC), lo cual no solo impacta en el costo si no también en los resultados esperados en salud de los pacientes que están siendo tratados con este medicamento.
Que por otra parte, en relación con los resultados de la costo/efectividad, como lo presenta la evaluación económica la GPC, la alternativa de efavirenz tiene una probabilidad de 0 a 5% de ser costo efectiva, mientras que la alternativa con DTG tiene un 30% de probabilidad de ser costo efectiva, obtiene mayores años de calidad ajustados por calidad frente a la estrategia que contiene efavirenz, de allí la preferencia y la necesidad para tratar pacientes con VIH.
Que, con relación a afirmación de que “la estimación del impacto presupuestal calculada por el Comité se asume una tasa de adopción del 100% de la terapia que incluye Dolutegravir”, se aclara que no se está asumiendo una tasa de adopción del 100%, tal como se muestra en la tabla 13 del informe (“Números de casos totales proyectados de PVVIH”), pues no es la misma población que se prioriza para el cambio de tratamiento con DTG, es tan así que por ejemplo para 2024 de los 184.913 casos proyectados se espera atender 47.405, lo cual corresponde al 26% de la PVVIH proyectada.
Que en cuanto al precio reportado en el informe corresponde al cálculo realizado con los datos de SISMED 2022 que eran con los que se contaban al momento de la expedición de la resolución 881 de 2022, como se dio respuesta en el derecho de petición los cálculos se actualizaron de acuerdo con el último reporte disponible (segundo trimestre 2023), en el Sistema de Información de Precios de Medicamentos (SISMED).
Que las demás observaciones al informe de recomendaciones fueron resueltas en la parte general de este acto administrativo.
4.2.2.7 Fundación ANCLA de Medellín, la Organización Pacientes Colombia, Asociación Colombia Saludable y Mecanismo de Apoyo control en VIH de Colombia - MSACVCO
Que como quiera que la información relacionada con el presunto desabastecimiento del medicamento en el país, la autonomía médica y la calidad y seguridad de los medicamentos genéricos que podrían surgir como resultado de la eliminación de la patente, han sido temas que se han desarrollado a lo largo de este acto administrativo, por efectos prácticos y metodológicos, y con el propósito de no incluir información repetitiva, el Ministerio de Salud y Protección Social no realizará ningún pronunciamiento adicional al respecto.
4.2.8. Fundación IFARMA Colombia, Richard Stern, Fundación Grupo Efecto Positivo Argentina, RedLAM (Red Latinoamericana por el Acceso a Medicamentos), Red Argentina de Personas Positivas, Sergio Isaza Villa, Oscar Andia Salazar, Sandra Ávila AHF, John Harold Estrada M. ALAMES - Colombia, Aids HealthCare Foundation Colombia, FEDESALUD. Colombia, Acción Internacional para la Salud - Perú. G.T.P.I. Grupo de Trabalho sobre Propriedade Intelectual Brasil, Asociación ABIA. Brasil, Fundación Tradición Oral Colombia, Salud y Fármacos Estados Unidos, Andrea Carolina Reyes Rojas, Fundación Comunicación Positiva Colombia, David Morales Alba, World Association for Christian Communication (WACC), Liga Colombiana de Lucha contra el SIDA.
Que debido a que se trata de una posición subjetiva frente a una eventual declaratoria de interés público, así como información que ya se encuentra en el expediente, el Ministerio de Salud y Protección Social no realizará ningún tipo de pronunciamiento de fondo al respecto.
4.2.2.9 Instituto de Ciencia Política Hernán Echavarría Olózaga
Que en razón a que las observaciones dirigidas a discutir la presunta innovación impulsada por las patentes, han sido temas que se han desarrollado a lo largo de este acto administrativo, por efectos prácticos y metodológicos, y con el propósito de no incluir información repetitiva, el Ministerio de Salud y Protección Social no realizará ningún pronunciamiento adicional al respecto.
4.2.2.10. Access Campaign - Medecins Sans Frontieres
Que debido a que se trata de una posición subjetiva frente a una eventual declaratoria de interés público, así como información que ya se encuentra en el expediente, el Ministerio de Salud y Protección Social no realizará ningún tipo de pronunciamiento de fondo al respecto.
4.2.2.11. ONUSIDA para los países de la Región Andina
Que frente a sus observaciones es preciso manifestar que el Ministerio de Salud y Protección Social no busca estigmatizar a la población venezolana por el aumento de casos de la población colombiana; por el contrario el documento de recomendaciones indicó que, sumada la prevalencia en la población general venezolana en Barranquilla y Soledad es mayor a 1.0%, por lo cual, se estaría presentando una epidemia generalizada en esa población. No hace referencia a que el aumento en el número de casos en Colombia sea responsabilidad de la población venezolana.
Que no obstante ello, el estado Colombiano sí requiere darle a la población venezolana una atención en salud frente a su estado positivo de VIH, en el marco del derecho a la salud de toda persona y el impacto que pueden tener la interacción de las poblaciones receptoras y migrantes en el número de casos que se reportan en el país.
Que debe dejarse claro que el fin que se busca con la declaratoria de interés público es mejorar el acceso al tratamiento de primera línea de acuerdo a la GPC Colombia.
4.2.2.12. Property Rights Alliance
Que las observaciones dirigidas a discutir las obligaciones internacionales, la inversión, innovación y presunto crecimiento económico impulsado por las patentes, han sido temas que se han desarrollado a lo largo de este acto administrativo: Por esto, atendiendo la metodología delimitada a lo largo del acto administrativo para evitar incluir información repetitiva, el Ministerio de Salud y Protección Social no realizará ningún pronunciamiento adicional al respecto.
Que pese a lo anterior, se aclara que la aplicación de la normatividad internacional e internacional no es una intromisión del gobierno en asuntos del sector privado, pues esta declaratoria se estudia en el marco de la soberanía nacional y en el derecho a la salud instituido como fundamental a través de la Constitución y la Ley 1751 de 2015, por ende es irrenunciable en lo individual y colectivo y que se ejecuta bajo la indelegable dirección, supervisión, organización, regulación, coordinación y control del Estado.
4.2.2.13. José Luis Reyes Villamizar
Que en pronunciamiento a sus observaciones, se informa que se dará estricto cumplimiento al marco normativo regulado en el Decreto 1074 de 2015, en lo que tiene que ver con la expedición de la licencia obligatoria y la compensación económica a ser fijada.
4.2.2.14. Superintendencia de Industria y Comercio
Que debido a que se trata una recomendación con relación a la limitación de la patente, será objeto de análisis en el acápite denominado “Identificación de las patentes sobre las composiciones farmacéuticas cuyo principio activo es el Dolutegravir que deberían ser licenciadas”.
4.2.2.15. Universidad Nacional de Colombia
Que atendiendo a que se trata de información que ya se encuentra en el expediente y ha sido desarrollada a lo largo del acto administrativo, el Ministerio de Salud y Protección Social no realizará ningún tipo de pronunciamiento de fondo al respecto.
4.2.2.16. Pablo Felipe Robledo
Que para atender sus observaciones se informa que los interrogantes que se relacionan a continuación, han sido desarrollados tanto en el informe de recomendaciones como a lo largo del acto administrativo, por este motivo el Ministerio de Salud y Protección Social no realizará ningún tipo de pronunciamiento de fondo al respecto:
- ¿Cómo ha sido el aumento de casos de VIH año a año? ¿Cómo se puede comparar con la tendencia en América Latina y otros países?
- ¿Cómo esta situación se convierte en una situación que amerite decretar una licencia obligatoria?
- ¿Están los pacientes diagnosticados con VIH teniendo barreras de acceso para recibir su tratamiento?
- ¿Existe otro tipo de medidas que puedan llevar a que se logre el objetivo propuesto?
- ¿Cuál es el papel del Estado colombiano en la prevención del VIH? ¿Cuáles han sido los resultados del Estado colombiano en la prevención del VIH?
Que con relación a los interrogantes restantes, se precisa que los datos que se presentan a continuación, corresponden a las estimaciones que obtienen los países a partir del software Spectrum que ONUSIDA provee cada año (debido a los ajustes que realiza la organización anualmente). Esta metodología se utiliza con el fin de tener parámetros de comparación entre los países, pero sus resultados están sujetos a la disponibilidad de los datos y la calidad de los mismos de un país a otro.
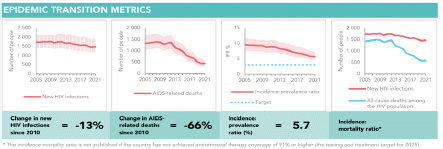
Fuente: data-book-ONUSIDA_2022.pdf
Fuente: data-book-ONUSIDA_2022.pdf
Que la tabla muestra como la tendencia es variable de acuerdo con los países analizados. De esta manera, Chile muestra un incremento progresivo en su incidencia mientras que Argentina muestra una reducción en esta misma medida epidemiológica. Colombia por su parte, muestra una reducción progresiva en su incidencia teniendo en cuenta que, la mayor parte de los datos con los que se alimenta el software de Spectrum, provienen de las estadísticas disponibles en población colombiana o migrantes regulares, dado que a la Cuenta de Alto Costo no se reporta aún la población migrante irregular.
Que aunque el software Spectrum estima que hubo una reducción en el número de nuevas infecciones reportadas, la notificación de casos al SIVIGILA refleja un aumento en el número de casos. Lo anterior, puede estar influenciado a que, en el software no se ha incluido la población migrante, y el último dato con que fue alimentado fueron los nuevos casos reportados en el año 2021, por lo tanto, es necesario observar la tendencia de esa estimación dado que está influenciada por la pandemia COVID 19.
De otro lado, la encuesta Bioconductual sobre el VIH, la sífilis y el estado de salud de los venezolanos que viven en Colombia (estudio Bienvenir), realizado en cuatro (4) ciudades del país entre los años 2021 y 2022, encontró una prevalencia de VIH de 0,9% entre personas migrantes y refugiadas procedentes de Venezuela, la cual osciló entre 0,8% en Bogotá y Soacha (IC 95%: 0,4-1,5) y 1,2% (IC 95%: 0,7-2,0) en Barranquilla y Soledad. Utilizando la prevalencia establecida para esta población, se estima que, entre los 2.477.588 refugiados y migrantes venezolanos en Colombia registrados a septiembre 2022, habría por lo menos 22.298 (IC95%: 14.865 - 34.686) personas que viven con VIH y que requieren un acceso continuo al tratamiento(51).
Que la prevalencia reportada en el estudio Bienvenir (0,9%), al ser comparada con la prevalencia estimada en la población general colombiana (0,5%), muestra que dicha prevalencia es casi el doble de la prevalencia en personas nacionales, lo cual, sumado a que la prevalencia en Barranquilla y Soledad es mayor al 1% en población general venezolana, significa que, en esta población, se estaría presentando una epidemia generalizada(52). Por tanto, es urgente para el país garantizar la atención de esta población, si se quiere evitar un impacto mayor en el comportamiento de la epidemia, tanto entre la población migrante como en la población colombiana, teniendo en cuenta que, de acuerdo con las definiciones de la OMS, este nivel de prevalencia es suficiente para la expansión de la epidemia en la población general(53).
Que en lo que corresponde a ¿cuál es la comparación entre la prevalencia de esta enfermedad en Colombia y la cifra mundial?, en todo el mundo, la media de la prevalencia del VIH entre los adultos (de 15 a 49 años) fue del 0,7 %. Sin embargo, la media de la prevalencia fue mayor entre los grupos de población clave[1], mientras que en Colombia el estimado de la prevalencia nacional en el mismo grupo poblacional (entre adultos de 15 a 49 años) es de 0,5% (0,4% - 0,6%)(54).
Que frente a la pregunta, ¿cuál es la cifra de mortalidad por VIH en el país?, las cifras de mortalidad por VIH en Colombia son las que se relacionan enseguida:
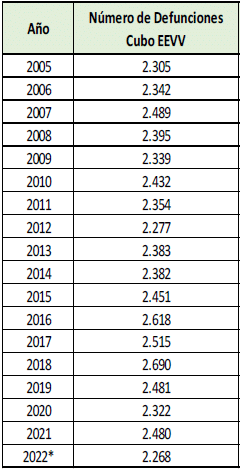
Fuente: Estadísticas Vitales - EEVV, consultado en la bodega de datos del SISPRO el 19 de abril de 2023. *Los datos del 2022 son preliminares.
En lo que corresponde a las medidas que implementa el Estado Colombiano, se hace saber que el Ministerio de Salud y Protección Social (MSPS) ha adelantado en los últimos años estrategias orientadas a la detección temprana y atención oportuna de las personas que viven con VIH, algunas de estas acciones son:
- Inclusión en la Resolución 518 de 2015(55), el tamizaje para VIH en poblaciones vulnerables (hombres que tienen relaciones sexuales con hombres, mujeres transgénero, personas que se inyectan drogas, personas en situación de prostitución y habitantes de calle), en el marco de las actividades del Plan de Intervenciones Colectivas. Esta directriz fue ratificada en el anexo técnico de la Ruta Integral de Atención para la Promoción y el Mantenimiento de la Salud (RIA-PMS, Resolución 3280 de 2018), la cual mantiene el tamizaje para este evento para las poblaciones vulnerables en el marco de las intervenciones colectivas 109.
- Tamizaje para VIH a personas a partir de los 12 años de edad ante la presencia de factores de riesgo (relaciones sexuales sin protección) en el marco de la Ruta Integral de Atención para la Promoción y Mantenimiento de la Salud establecida en la Resolución 3280 de 2018(56).
- Continuidad en el tamizaje para VIH a todas las gestantes, el cual estaba incluido desde la Resolución 412 del 2000[3] y se mantiene en la Ruta Integral de Atención Materno Perinatal, establecida en la Resolución 3280 de 2018.
- Emisión de la Resolución 1314 de 2020[4] del MSPS “Por la cual se adoptan los lineamientos para la realización de pruebas rápidas fuera del laboratorio clínico para el diagnóstico temprano de la infección por VIH, sífilis, hepatitis B y hepatitis C”, a través de la cual se ampliaron los perfiles que pueden entrenarse en la realización de estas pruebas rápidas y se dio la opción de confirmación del diagnóstico de VIH a nivel extramural con una segunda prueba rápida de diferente plataforma tecnológica.
- Fortalecimiento del tamizaje a poblaciones clave a través del proyecto VIH del Fondo Mundial de lucha contra el SIDA, la tuberculosis y la malaria, el cual, con más de 20 años de apoyo al país, hace búsqueda activa de estas poblaciones, actividades educativas, entrega de paquetes de prevención que incluyen condones y lubricantes y, en el caso de personas que se inyectan drogas, incluye la entrega de agujas y jeringas nuevas y otros materiales para la inyección de menos riesgo. Así mismo, ofrece la prueba de VIH, y la prueba confirmatoria a quienes presentan un resultado reactivo en la primera prueba y realiza el acompañamiento necesario para el ingreso a los servicios de salud. A través de esta intervención se identificaron 1.919 personas reactivas para VIH en el año 2019, 2477 en el año 2020, 4.013 en el año 2021 y 5.734 en el año 2022.(57)
- De acuerdo con la CAC el porcentaje de personas identificadas en estadio 1 y 2 ha oscilado entre el 57,5% y el 61,3% entre los años 2016 y 2021, lo que demuestra la necesidad de continuar el fortalecimiento de la oferta de la prueba de VIH a través de estrategias que cubran diferentes puntos de entrada, al diagnóstico y a las atenciones en salud utilizando el auto-test,el cual ha estado disponible a través de proyectos como el Fondo Mundial, a través del cual se entregaron 14.800 pruebas en el año 2022, y su disponibilidad en farmacias para compra con gasto de bolsillo desde diciembre de 2022(58).
Que como algunos de los resultados del Estado en la prevención del VIH se tiene la emisión de los lineamientos para la implementación de la PrEP para VIH en Colombia (Profilaxis preexposición-PrEP) en Colombia, socialización e inicio de los programas por parte de las EPS(59).
5. EXISTENCIA DE LOS ELEMENTOS PARA DECLARAR INTERÉS PÚBLICO
5.1.1 Identificación de las situaciones que afectan el interés general
De acuerdo con las observaciones de los terceros interesados Access Campaign - Medecins Sans Frontieres/Doctors Without Borders (MSF), José Luis Reyes Villamizar, Universidad Nacional de Colombia, Fundación IFARMA Colombia, Richard Stern, Fundación Grupo Efecto Positivo Argentina, RedLAM (Red Latinoamericana por el Acceso a Medicamentos), Red Argentina de Personas Positivas, Sergio Isaza Villa, Óscar Andia Salazar, Sandra Ávila AHF, John Harold Estrada M. ALAMES - Colombia, Aids HealthCare Foundation Colombia, FEDESALUD. Colombia, Acción Internacional para la Salud - Perú. G.T.P.I. Grupo de Trabalho sobre Propriedade Intelectual Brasil, Asociación ABIA. Brasil, Fundación Tradición Oral Colombia, Salud y Fármacos Estados Unidos, Andrea Carolina Reyes Rojas, Fundación Comunicación Positiva Colombia, David Morales Alba, World Association for Christian Communication (WACC), Liga Colombiana de Lucha contra el SIDA, el informe técnico desarrollado por el Comité Técnico Interinstitucional -conformado por el Ministerio de Salud y Protección Social (MSPS), entidad responsable de la secretaría técnica, el Ministerio de Comercio, Industria y Turismo (MINCIT) y el Departamento Nacional de Planeación (DNP)- y los documentos aportados por los terceros interesados en el procedimiento administrativo, se evidencian las siguientes situaciones a saber:
i) Aumento en el número de casos reportados de VIH en Colombia
a) A través del programa de estimaciones estadísticas para VIH, denominado Spectrum, se estimó que para el año 2021 en Colombia aproximadamente 9.400 personas adquirieron el VIH, con una tasa de incidencia de 16 por cada 100.000 personas (0,16 por cada 1000), reflejando una reducción frente a años anteriores.
Gráfica 5. Nuevas infecciones por VIH estimadas por Spectrum
Fuente: Ministerio de Salud y Protección Social, estimaciones de incidencia por Spectrum, 2023.
Nota: Las líneas punteadas reflejan el límite inferior y superior de la estimación.
b) Sin embargo, estos datos estimados contrastan con los informes de VIH del SIVIGILA, los cuales muestran por su parte que, la notificación de casos de VIH en Colombia viene en aumento en los últimos años, pasando de 28,2 casos por 100.000 habitantes en el año 2018 a 36,3 casos por 100.000 habitantes en el año 2022, solo con una declinación en el año 2020 probablemente ocasionada por la reducción en la búsqueda de casos a nivel comunitario e institucional debido a las restricciones de la pandemia por COVID-19.
Gráfica 6. Tendencia en la tasa de casos de VIH notificados al SIVIGILA, 2018-2022
Fuente: basada en los informes del evento VIH 2018 y 2022 del Instituto Nacional de Salud.
De acuerdo con la gráfica reportada por el Instituto Nacional de Salud (INS), el número absoluto de casos ha presentado un incremento significativo de 32,5%, pasando de 14.474 casos en 2018 a 19.183 casos en 2022(60).
c) En concordancia con lo anterior, se reportó un incremento de pruebas realizadas, tanto a hombres como mujeres en el período 2019-2022, así:
Gráfica 7. Número de pruebas de VIH años 2019 a 2022
Fuente: RIPS. Datos preliminares para el año 2022.
d) Por su parte, la Cuenta de Alto Costo (CAC), reportó para el periodo comprendido entre el 1 de febrero de 2021 al 31 de enero de 2022, un total de 12.919 casos incidentes. El SIVIGILA para el período enero-diciembre 2021 reportó un total de 17.876 casos.
En este reporte debe considerarse que, un porcentaje de las personas notificadas al SIVIGILA no llegan anualmente a ser reportadas a la Cuenta de Alto Costo (CAC) por limitantes como: barreras de acceso a los servicios de salud relacionadas con factores de vulnerabilidad como habitantes de calle, migrantes irregulares, personas sin afiliación, entre otros.
Tabla 2. Síntesis del comportamiento de la notificación de VIH, Colombia 2018-2022
| Variable | 2018 | 2019 | 2020 | 2021 | 2022 |
| N° nuevos casos notificados | 14.474 | 17.346 | 13.605 | 17.876 | 19.183 |
| Entidad territorial de procedencia con densidad de casos | Bogotá 2.960 casos Antioquia 2.225 casos Valle del Cauca 1.726 casos Cundinamarca 554 casos Santander 489 casos Barranquilla 485 casos | Bogotá 3.562 casos Antioquia 2.542 casos Cali 1.357 casos Córdoba 789 casos Valle del Cauca 642 casos Cundinamarca 640 casos | Bogotá 3.160 casos Antioquia 2.087 casos Valle del Cauca 1.326 casos Barranquilla 569 casos Santander 525 casos Córdoba 514 casos | Bogotá 4.136 casos Antioquia 2.618 casos Valle del Cauca 1.879 casos Cundinamarca 799 casos Barranquilla 719 casos | Bogotá 3.915 casos Antioquia 2.825 casos Cali 1.483 casos Barranquilla 912 casos Cundinamarca 776 casos Valle del Cauca 699 casos |
| Procedentes del exterior | Total: 410 Venezuela 382 (93,4%) | Total: 907 Venezuela 870 (95,9%) | Total 401 Venezuela 363 (90,5%) | Total 448 Venezuela 389 (86,8%) | Total 417 Venezuela 352(84,4%) |
| Sexo | Hombres 11.668 (80,6%) Mujer 2.806 (19,4%) | Masculino 13.998 (80,7%) Femenino 3.348 (19,3%) | Masculino 11.036 (81,1%) Femenino 2.569 (18,9%) | Masculino 14.471 (81%) Femenino 3.405 (19%) | Masculino 15.529 (80,9%) Femenino 3.654 (19,1%) |
| Grupos de edad con la mayor notificación de casos | 25 a 34 años: 5.152 (35,6%) 15 a 24 años 3.750 (25,9%) 35 a 44 años 2.610 (18,0%) 45 a 54 años 1.657 (11,4%) | 25 a 34 años 6.389 (36,8%) 15 a 24 años 4.289 (24,7%) 35 a 44 años 3.138 (18,1%) 45 a 54 años 1.990 (11,5%) | 25 a 34 años 5.000 (38,3%) 15 a 24 años 3.343 (25,3%) 35 a 44 años 2.593 (18,6%) 45 a 54 años 1.490 (9,9%) | 25 a 34 años 6.828 (38,19%) 15 a 24 años 4.471 (25,01%) 35 a 44 años 3.330 (18,62%) 45 a 54 años 1.810 (10,12%) | 25-29 años 4.201 (21.90%) 20-24 años 3.584 (18,68%) 30-34 años 3.071 (16,01%) 35-39 años 2.049 (10,68%) |
| Régimen de aseguramiento | Contributivo 7.443 (51,4%) Subsidiado 5.913 (40,9%) No asegurado 805 (5,6%) Especial 142 (1,0%) Excepción 125 (0,9%) Indeterminado 46 (0,3%) | Contributivo 8.297 (47,8%) Subsidiado 7.174 (41,4%) No asegurado 1.442 (8,3%) Especial 25 (0,1%) Excepción 306 (1,8%) Indeterminado 102 (0,6%) | Contributivo 6.213 (45,7%) Subsidiado 5.167 (38,0%) No asegurado 1.525 (11,2%) Excepción 555 (4,1%) Especial 7 (0,1%) Indeterminado 138 (1,0%) | Contributivo 8.348 (46,79%) Subsidiado 6.576 (36,78%) No asegurado 2.385 (13,34%) Excepción 453 (2,53%) Indeterminado 114 (0,63%) | Contributivo 9.039 (47,12%) Subsidiado 7.660 (39,93%) No asegurado 1.842 (9,6%) Excepción 433 (2,26%) Indeterminado 209 (1,09%) |
Fuente: Informe de recomendaciones del Comité Técnico Institucional sobre la declaración de interés público de los medicamentos cuyo principio activo es el Dolutegravir con fines de licencia obligatoria. Año 2023.
*En el año 2022 el Instituto Nacional de Salud modificó los grupos etarios para el reporte del informe de VIH.
e) Se ha presentado un incremento en el reporte de diagnósticos de VIH de personas procedentes del exterior, de esta manera, en el año 2018 fueron reportados 410 casos y en 2019 se reportaron 907 casos, durante un período de alta afluencia de migrantes a nuestro país.
Aunque en el año 2020 la tendencia creciente se invirtió con un reporte de 401 casos, lo cierto es que para el año 2021 nuevamente se incrementó la cifra alcanzando 448 casos y en el año 2022 se reportaron 417, estabilizándose la tendencia del reporte(61).
f) En concordancia con ese reporte, la encuesta Bioconductual sobre el VIH, la sífilis y el estado de salud de los venezolanos que viven en Colombia (Estudio Bienvenir), que fue realizada en cuatro (4) ciudades del país entre los años 2021 y 2022, encontró una prevalencia de VIH de 0,9% entre personas migrantes y refugiadas procedentes de Venezuela. Esta cifra osciló entre 0,8% en Bogotá y Soacha (IC 95%: 0,4-1,5) y 1,2% (IC 95%: 0,7-2,0) en Barranquilla y Soledad.
Utilizando la prevalencia establecida para esta población, se estima que, entre los 2.477.588 refugiados y migrantes venezolanos en Colombia registrados a septiembre 2022, habría por lo menos 22.298 (IC 95%: 14.865 - 34.686) personas que viven con VIH y que requieren un acceso continuo al tratamiento.(62)
g) El estudio Bienvenir estableció la cascada de atención al VIH entre los participantes con infección confirmada por VIH encontrando que, aproximadamente el 47,9% de las personas estimadas con VIH han sido diagnosticadas, el 38% reciben tratamiento antirretroviral y el 35,2% tienen carga viral suprimida. Esta cascada muestra que aquellos que están accediendo al tratamiento, tienen una buena respuesta al mismo, pero que aún son muchos los que faltan por diagnosticarse y tratarse en el país.
Gráfica 8. Continuidad de la atención al VIH entre los participantes con infección por VIH confirmada por laboratorio (n=71)
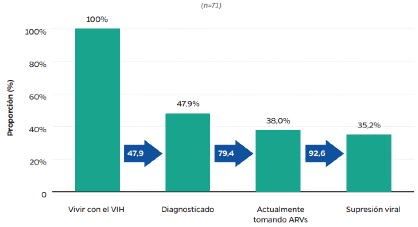
Fuente: Estudio Bienvenir.
h) En Colombia para el año 2021, de acuerdo con el software Spectrum(63), se estima que había en el país un número aproximado de 180.000 (150.000 - 240.000) personas viviendo con VIH, de las cuales el 77% conocía su diagnóstico, el 68% recibía tratamiento antirretroviral y el 61% tenía carga viral suprimida.
Estos porcentajes corresponden, según los datos de la Cuenta de Alto Costo para el periodo del 1 de febrero de 2021 a 31 de enero de 2022, a 141.787 personas con diagnóstico de VIH, 125.264 personas recibiendo tratamiento antirretroviral y 97.862 personas con carga viral suprimida(64).
ii Falta de unificación en el tratamiento del VIH que dificultan seguir recomendaciones internacionales
a) El informe anual de la Cuenta de Alto Costo reportó que para el periodo 2021 a 2022 21.572 personas presentaban falla terapéutica, correspondiente al 15,21% del total de personas reportadas a la CAC(65).
Tratándose de la falla terapéutica, reporta el Comité Técnico Interinstitucional que se trata de la situación en la cual un régimen antirretroviral es incapaz de controlar la infección por VIH y los factores que pueden contribuir a la falla del tratamiento incluyen, entre otros, resistencia a los medicamentos, toxicidad del esquema y pobre adherencia a la terapia antirretroviral por parte del usuario (66).
b) En el año 2017 la Organización Mundial de la Salud (OMS) publicó el Informe sobre la farmacorresistencia del VIH, en el que reporta que en 6 de los 11 países que fueron evaluados en África, Asia y América Latina, más del 10% de los individuos que inician un pretratamiento con inhibidores no nucleosídicos de la retrotranscriptasa (INNRT) son portadores de una cepa resistente. Estos resultados demuestran una tendencia al aumento de la farmacorresistencia del VIH, como consecuencia la OMS emite una alerta con el fin de que los países adopten medidas para afrontar la situación.(67)
c) Por la anterior situación, en el año 2018 la OMS propuso la medida de contemplar el uso de prescripción de fármacos como el Dolutegravir en monofármaco o en combinación con fumarato de disoproxilo de tenofovir (TDF), lamivudina y Dolutegravir (TLD) como esquema terapéutico de primera línea preferido para iniciar el tratamiento antirretroviral (TAR) en adultos y adolescentes con infección por el VIH. El Dolutegravir (DTG) se recomienda también como opción preferida en los esquemas de segunda línea para el tratamiento de personas en las que ha fallado un esquema de primera línea basado en un inhibidor no nucleósido de la transcriptasa inversa (INNTI).(68)
d) Aquella recomendación se mantuvo en el año 2019, toda vez que la OMS indicó que los programas de VIH deben planificar cuidadosamente el suministro de Dolutegravir para garantizar que esté disponible para satisfacer la demanda anticipada, y recomienda un enfoque gradual para la implementación. (69)
e) En julio de 2021, la OMS publicó la actualización de las directrices unificadas sobre la infección por el VIH, en las que se proporciona más apoyo para la adopción del Dolutegravir como opción preferida en el tratamiento antirretroviral de primera y segunda línea para todos los grupos de población, debido a los datos de seguridad tranquilizadores, incluso para las mujeres y las adolescentes que lo usan durante el período que rodea a la concepción (70).
Para este despacho las dos situaciones antes expuestas afectan el interés público, toda vez que a pesar de que el VIH es una infección prevenible, la tendencia al aumento hace que se pueda catalogar como un problema de salud pública que debe ser tratado para alcanzar el bien común y la dignidad humana de aquellas personas que lo padecen, a través de tratamientos eficientes y unificados que disminuyan la resistencia a los medicamentos.
En este orden de ideas, se requiere de la intervención del Estado para la protección, promoción y recuperación de la salud con el propósito de garantizar la prestación de un servicio integral, continuo y eficaz, dando aplicación a políticas y mecanismos legalmente establecidos para contribuir a la realización de los fines del Estado, tales como servir a la comunidad, promover la prosperidad general y garantizar la efectividad de los derechos a la vida y la salud consagrados en la Constitución.
5.12. Circunstancias que llevan a la declaración de interés público frente al medicamento Dolutegravir
i) Ausencia de uso del Dolutegravir como esquema en primera y segunda línea.
En concepto de la OMS, el Dolutegravir “es más eficaz, más fácil de administrar y tiene menos efectos secundarios que otros medicamentos actualmente en uso (…) también tiene una barrera genética alta a la farmacorresistencia, lo que refuerza su durabilidad y eficacia a largo plazo. Desde que se llevaron a cabo las encuestas, muchos más países han iniciado la transición a regímenes que contienen Dolutegravir, proporcionando así una mejor opción de tratamiento a las personas y reforzando la lucha contra la farmacorresistencia”(71).
De acuerdo con esta tesis, el Comité Técnico Interinstitucional concluyó que el Dolutegravir presenta una ventaja importante, ya que esporádicamente induce la aparición de mutaciones que confieren resistencia, comunes para los INI de primera generación(72), habida cuenta que posee una barrera genética más alta que los demás fármacos del grupo INI, convirtiéndolo así en el fármaco de elección para la Organización Mundial de la Salud (OMS). Asegura el Comité que, su administración es más sencilla en cuanto se reduce a una toma diaria, lo cual “influye de manera positiva en la adherencia al tratamiento y cuenta con un bajo perfil de toxicidad e interacciones, además de contar con una buena difusión en líquido cefalorraquídeo”(73).
Dadas las características de este medicamento, según la Guía Práctica Clínica (GPC), se sugiere el esquema en los siguientes casos:
- En personas con edad igual o mayor a 18 años con diagnóstico de infección por VIH sin experiencia previa con antirretrovirales(74).
- En gestantes mayores a 18 años viviendo con VIH sin experiencia previa con antirretrovirales e independientemente de la edad gestacional(75).
Lo anterior, por cuanto en un estudio de evidencia científica para la atención de la infección por VIH/SIDA en personas adultas, gestantes y adolescentes arrojó como resultado que, en términos de efectividad, los esquemas basados en Dolutegravir (DTG) obtuvieron mayores años de vida ajustados por calidad (AVAC), ocupando las primeras posiciones dentro de las opciones terapéuticas disponibles.(76)
Ahora bien, en personas con falla virológica en las guías consolidadas para la prevención, diagnóstico, tratamiento, prestación de servicios y monitoreo del VIH, 2021, la OMS indica que, en personas en necesidad de una segunda línea de tratamiento, Dolutegravir en combinación con un backbone optimizado de inhibidores nucleósidos de la transcriptasa reversa es el esquema preferido de segunda línea para personas que viven con VIH que no recibían Dolutegravir en su esquema inicial(77).
En el caso de profilaxis post-exposición en adolescentes y adultos con exposición no ocupacional y ocupacional, tanto la Guía de Práctica Clínica basada en la evidencia científica para la atención de la infección por VIH/SIDA en personas adultas, gestantes y adolescentes 2021 de Colombia.(78), como la guía consolidada de prevención, pruebas, tratamiento, seguimiento del VIH de la OMS, recomiendan como régimen de primera línea el esquema basado en Dolutegravir, principalmente considerando los efectos neuropsiquiátricos que puede tener el efavirenz, el cual, por sus efectos sobre el sistema nervioso central, puede agravar cuadros de ansiedad o estrés postraumático que pueden presentar las personas tras la exposición al virus(79).
Por último, en el caso de personas migrantes, especialmente de Venezuela, en la “Declaración Conjunta de la VIII Reunión Técnica Internacional sobre Movilidad Humana de Personas Venezolanas en la Región año 2022”(80), los Estados miembros, se comprometieron a dar cumplimiento a las recomendaciones de Organización Panamericana de Salud (OPS) y ONUSIDA, sobre continuar con los esfuerzos para acelerar la transición a TLD (Tenofovir, Lamivudina y Dolutegravir) y en la eliminación de las barreras en el acceso al tratamiento antirretroviral (TARV)(81). De igual manera, en el documento “Propuesta para incrementar la cobertura de salud de las personas refugiadas y migrantes con VIH de la República Bolivariana de Venezuela año 2021”(82), se menciona el acuerdo de los países para realizar la transición a tratamientos con Dolutegravir para población migrante.
No obstante, pese a las recomendaciones y la evidente eficacia del medicamento para disminuir la tendencia a la propagación del VIH, se advierte que para el periodo comprendido 1 de febrero de 2021 y el 31 de enero de 2022, en Colombia los esquemas terapéuticos más frecuentes en los pacientes incidentes reportados en el periodo, fueron: en primer lugar, efavirenz, emtricitabina y tenofovir (41,13%), seguido de atazanavir, emtricitabina, ritonavir y tenofovir (21,93%), mientras que los esquemas que contenían Dolutegravir en combinación representan únicamente el 13,89%.
En cuanto a la terapia antirretroviral usada en los casos prevalentes, los esquemas terapéuticos más frecuentes fueron efavirenz, emtricitabina y tenofovir (26,40%), atazanavir, emtricitabina, ritonavir y tenofovir (15,47%) y abacavir, efavirenz, lamivudina (10,90%). Solamente, el 8,38% de las PVV recibiendo TAR basado en Dolutegravir(83).
De lo expuesto hasta aquí, se advierte la necesidad de implementar los tratamientos con el uso del Dolutegravir dadas sus características (i) para disminuir la tendencia a la propagación del VIH y (ii) unificar el tratamiento de las personas diagnosticadas con la enfermedad, toda vez que claramente en Colombia no se utiliza el esquema basado en este medicamento en primera y segunda línea.
Muestra de esta situación es que en el año 2021, Colombia se reportó como uno de los países con menor uso de este medicamento, con solo un 5,36% de personas en primera línea con esquemas de tratamiento basados en Dolutegravir, en la región de Latinoamérica y el Caribe (gráfica 6)(84).
Gráfica 9. Dolutegravir como primera línea de tratamiento para el VIH
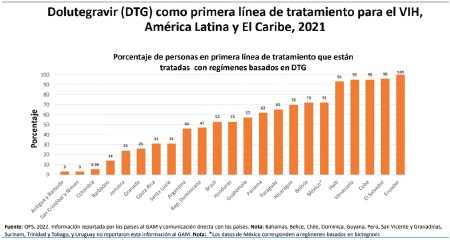
* Visible en el informe de recomendaciones*
ii. Acceso al tratamiento por parte de la población migrante
La respuesta nacional para la atención de los migrantes venezolanos que viven con VIH, particularmente aquellos que no han regularizado su estatus migratorio, ha estado siendo apoyada por organismos de cooperación internacional quienes proveen de manera transitoria tratamiento antirretroviral con los esquemas basados en Dolutegravir, hasta tanto las personas puedan vincularse al Sistema General de Seguridad Social en Salud. Esta vinculación es dependiente de la regularización del estado migratorio y de la posibilidad de recibir la encuesta del SISBEN. Sin embargo, muchos migrantes tienen alta movilidad debido a su inestabilidad económica, lo que hace que no tengan un sitio fijo de residencia y puede desembocar en la pérdida del aseguramiento al no lograr cumplir el requisito del SISBEN.
Aid For Aids (AFA) y Aids Healthcare Foundation (AHF) han estado facilitando las atenciones en VIH a los migrantes irregulares en Colombia y migrantes pendulares, incluyendo el tratamiento antirretroviral, en su mayor parte, basado en Dolutegravir, y adquirido a través de donaciones recibidas principalmente del Ministerio de Salud de Brasil, PEPFAR (Plan de Emergencia del Presidente de los Estados Unidos para el Alivio del SIDA, por sus siglas en inglés) y otras gestionadas por estas organizaciones. Sin embargo, AHF ha llamado la atención frente a los cambios en esquema terapéutico que sufren los pacientes cuando son regularizados y pasan a ser atendidos con los recursos del sistema de salud, indicando que es “inaceptable” cambio a esquemas de menor tolerabilidad y menor barrera a las resistencias, principalmente por razones de costos.
Si se quisiera reasumir la administración del tratamiento a esta población, Colombia no tendría la capacidad para continuar con el uso del Dolutegravir, pues el aumento del costo de este medicamento dificulta el acceso y limita la cantidad de personas con acceso al medicamento recomendado.
iii. Impacto financiero en el uso de recursos de naturaleza pública
De acuerdo con el análisis realizado por el Comité Técnico, se estima que el tratamiento anual con Dolutegravir (TIVICAY® 50 mg) por paciente bajo el precio reportado en el SISMED tendría un costo de $4.818.894 frente al ofrecido por la OPS con un costo anual $173.893, lo que implica una diferencia $ 4.645.001 con lo cual se puede atender con tratamiento a 27 personas más que con la molécula comercial.
De acuerdo con los datos de la cuenta de alto costo con corte a enero de 2022(85) el país registró 12.919 nuevos casos y 141.787 casos prevalentes de los cuales el 88% recibe tratamiento TAR, así las cosas, bajo el supuesto que estos pacientes accedan al tratamiento con el medicamento dispuesto en el listado de la OPS, el costo anual sería de $23.839.366., generando un ahorro estimado al sistema de $636.792.420.024 (ver Tabla 6). Por su parte, en la tabla 6 se muestran las estimaciones para la población migrante con un ahorro anual estimado en $13.011.392.324.
Tabla 3. Costo tratamiento anual con Dolutegravir para casos prevalentes e incidentes a partir de los datos de la CAC
| Medicamento | Vr. mensual | Vr. anual x persona | No Personas prevalentes más incidentes | Vr. total anual |
| Dolutegravir (TIVICAY® 50 MG) | $ 401.574 | $ 4.818.894 | 137.092 | $683.256.492.913 |
| Dolutegravir (OPS) | $ 14.491 | $ 173.893 | 137.092 | $24.655.795.148 |
Tabla 4. Costo tratamiento anual con Dolutegravir para casos prevalentes de migrantes a partir de las metas del Banco Mundial
| Medicamento | Vr. mensual | Vr. anual x persona | No Personas prevalentes | Vr. total anual |
| Dolutegravir (TIVICAY® 50 MG) | $ 401.574 | $ 4.818.894 | 2.800 | $13.492.902.594 |
| Dolutegravir (OPS) | $ 14.491 | $ 173.893 | 2.800 | $ 481.510.271 |
Ahora bien, teniendo en cuenta que los cálculos realizados están basados en los datos de 2022, el Comité Técnico realizó una proyección del número de casos incidentes y prevalentes a partir de los datos reportados en los informes de la cuenta de alto costo, para esto se siguieron los siguientes pasos:
1. Se tomaron el número de casos (personas prevalentes y recién diagnosticadas con VIH) reportados por la CAC desde 2012 hasta 2022
Tabla. 5. Casos año a año
| Año | No casos |
| 2012 | 37.325 |
| 2013 | 46.347 |
| 2014 | 53.408 |
| 2015 | 61.714 |
| 2016 | 73.465 |
| 2017 | 82.856 |
| 2018 | 95.745 |
| 2019 | 109.056 |
| 2020 | 123.490 |
| 2021 | 134.636 |
| 2022 | 141.787 |
Fuente: Cuenta de Alto Costo
2. Se realizó el cálculo para los años 2023, 2024 y 2025 con el método de mínimos cuadrados, el cual consiste en determinar la función continua que mejor se aproxime a los datos (línea de regresión o la línea de mejor ajuste). Este método se utiliza comúnmente para analizar una serie de datos de algún estudio, con el fin de expresar su comportamiento de manera lineal y así minimizar los errores de la data tomada, en este caso los datos fueron tomados de los informes de VIH de la CAC.
Y=a+(b*-X)
Donde a corresponde al número de casos, X es igual al año
Gráfica 10. Tendencia de casos prevalentes 2012-2022
Fuente: Informe de recomendaciones del Comité Técnico Institucional sobre la declaración de interés público de los medicamentos cuyo principio activo es el Dolutegravir con fines de licencia obligatoria. Año 2023.
A partir de los datos reportados por CAC, el Comité calcula que aproximadamente para el año 2023 se esperarían 152.853 casos prevalentes, para el 2024 163.786 casos y 174.719 casos para el 2025
Gráfica 11. Tendencia de casos incidentes
Fuente: Informe de recomendaciones del Comité Técnico Institucional sobre la declaración de interés público de los medicamentos cuyo principio activo es el Dolutegravir con fines de licencia obligatoria. Año 2023.
Por su parte, en relación con los casos incidentes se calcula que aproximadamente para el año 2023 se esperarían 13.009 casos, para el 2024 13.731 casos y 14.452 casos para el 2025.
Con relación a la población migrante infectada por VIH se partió de las metas establecidas con el Banco Mundial con un horizonte temporal de tres años se esperaría atender de 9.600 casos
Tabla 6. Metas atención PVIH migrante
| Año | Meta Número de casos |
| 2023 | 2.800 |
| 2024 | 4.800 |
| 2025 | 7.100 |
| Total | 14.700 |
Fuente: Informe de recomendaciones del Comité Técnico Institucional sobre la declaración de interés público de los medicamentos cuyo principio activo es el Dolutegravir con fines de licencia obligatoria. Año 2023.
Adicionalmente, teniendo en cuenta que actualmente las PVIH con estatus de migrante irregular están siendo atendidas por algunas Organizaciones No Gubernamentales con AHF y el Fondo Mundial, se hace necesario contarlas entre la población priorizada, dado que se les debe seguir garantizando el tratamiento ATR para no afectar su respuesta virológica.
Tabla 7.
| Año | AHF | Fondo Mundial | Total |
| 2023 | 2.199 | 1.074 | 3.273 |
| 2024 | 2.469 | 1.354 | 3.823 |
| 2025 | 2.740 | 1.637 | 4.377 |
De acuerdo con el número de personas que han sido reportadas a RIPS con el código CIE-10 Z206 (Contacto con y exposición al virus de la inmunodeficiencia humana - VIH) discriminado por año, de 2018 a 2022” se realizó la proyección de número de casos para 2023-2025.
Tabla 8.
| Año | Número de casos |
| 2018 | 2.073 |
| 2019 | 2.470 |
| 2020 | 1.903 |
| 2021 | 2.582 |
| 2022 | 2.404 |
| 2023 | 2.519 |
| 2024 | 2.596 |
| 2025 | 2.673 |
A continuación, se presenta el número total de casos proyectado que equivale a la sumatoria de las personas prevalentes, incidentes, migrantes y Personas que requieren profilaxis posexposición.
Tabla 9. Números de casos totales proyectados de PVVIH
| Año | Número de casos |
| 2023 | 171.066 |
| 2024 | 184.913 |
| 2025 | 198.944 |
Ahora bien, teniendo en cuenta las consideraciones de la historia natural de la enfermedad, las recomendaciones de la Organización Mundial de la Salud, la Guía de Práctica Clínica (GPC) basada en la evidencia científica para la atención de la infección por VIH/SIDA en personas adultas, gestantes y adolescentes del MSPS y de lo que implica cambiar el tratamiento TAR a toda la población en mención se propone el siguiente:
1. Migrantes
2. Migrantes irregulares atendidos por ONG
3. Atendiendo a la recomendación 12 de la GPC, iniciar a las personas que viven con VIH recién diagnosticadas
4. Con base a los indicadores establecidos en el consenso de VIH de la CAC(86) (2023) incluir a las pacientes que hacen falla virológica,
5. Personas que requieren profilaxis posexposición
Tabla 10. Estimación de costos de TAR con Dolutegravir con un horizonte temporal de 2 años
| Población | 2023 (n) | 2024 (n) | 2025 (n) |
| A. Migrantes regularizados en atención integral de VIH(87) | 2.800 | 4.800 | 7.100 |
| Población | 2023 (n) | 2024 (n) | 2025 (n) |
| B. Migrantes irregulares atendidos por ONG | 3.273 | 3.823 | 4.377 |
| C. Personas que viven con VIH recién diagnosticadas | 13.406 | 14.177 | 14.948 |
| D. Personas en falla virológica (15,21%)** | 20.540 | 22.009 | 23.478 |
| E. Personas que requieren profilaxis post exposición | 2.519 | 2.596 | 2.673 |
| Total población priorizada | 42.537 | 47.405 | 52.576 |
| Costo anual A+B+C+D+E con patente | $ 193.856.548.286 | $215.968.269.428 | $241.549.852.306 |
| Costo anual A+B+C+D+E (OPS) | $ 6.995.451.038 | $5.382.082.780 | $ 7.955.384.593 |
| Ahorro estimado | $186.861.097.248 | $210.586.186.649 | $233.594.467.713 |
El Comité estima que de llegar a realizar el cambio de TAR a la población priorizada por el medicamento genérico el SGSSS para el 2025 se podría redistribuir aproximadamente $212.502.651.511 COP en el fortalecimiento de la prevención, diagnóstico y tratamiento del VIH.
Finalmente, es importante mencionar que la evaluación económica realizada en el marco de la actualización de la GPC para el tratamiento Guía de Práctica Clínica (GPC) basada en la evidencia científica para la atención de la infección por VIH/SIDA en personas adultas, gestantes y adolescentes(88), concluye que el TAR que contiene DTG “en términos de efectividad, el esquema 3TC+DTG obtuvo mayores Años de Vida Ajustados por Calidad - AVAC.” Lista de Precios de Acuerdos a Largo Plazo (LTA1) del Fondo Estratégico 2023
Del análisis realizado por el Comité, llama la atención la importancia que debe darse a los recursos del sistema de salud, en tanto son públicos y deben tener una correcta y eficaz ejecución para una efectiva realización del derecho a la salud de la población. El sistema de salud ve en los precios altos un impacto financiero, por lo que la declaratoria de interés público implicaría un impacto positivo en ahorros anuales y globales para el sistema de salud.
Los costos de los medicamentos en tratamientos suministrados por el Estado se cubren con recursos públicos, que son además limitados y que están destinados a servir al interés público de la población colombiana: esto es, a garantizar y financiar los servicios de salud que requiere y a los que tiene derecho la población.
Por las razones expuestas, este despacho considera que la recomendación del Comité de declarar el medicamento como de interés público es acertada por cuanto está relacionada con la necesidad no solo de adoptar las recomendaciones de la OMS para mejorar la eficacia de los tratamientos del VIH, sino además de preservar los ahorros en el gasto público en salud derivados de los altos costos del Dolutegravir con el único propósito de aumentar la cobertura de pacientes con acceso a este medicamento.
5.1.3. Motivos por los cuales se debe licenciar la patente del Dolutegravir
El Ministerio de Salud y Prosperidad Social ha explorado medidas alternativas para atender la situación de salud pública generada a raíz de la infección actual a causa del VIH, de la siguiente manera:
1. En cumplimiento de lo establecido en el Acuerdo sobre los ADPIC, concretamente el inciso b del artículo 31 que dispone: “solo podrán permitirse esos usos cuando, antes de hacerlos, el potencial usuario haya intentado obtener la autorización del titular de los derechos en términos y condiciones comerciales razonables y esos intentos no hayan surtido efecto en un plazo prudencial”, el 18 de octubre de 2022 se sostuvo una reunión en el Ministerio de Salud y Protección Social, entre representantes del Ministerio y de GlaxoSmithKline Colombia S. A y ViiV Healthcare, titulares de las patentes objeto del procedimiento, en la que se exploraron alternativas para dar solución a los problemas de acceso a Dolutegravir en el país.
Entre las alternativas se les solicitó la expedición de una licencia voluntaria43 sobre la patente o bien la donación del medicamento para atender la gravosa y urgente situación de los migrantes venezolanos con VIH que se encuentran en territorio colombiano.
2. Ante la negativa de la expedición de la licencia voluntaria, se remitió correo electrónico el mismo 18 de octubre en el que se les solicitó a los titulares:
“(…)
- Obtener el medicamento a los precios de referencia de Wambo como Mecanismo de Adquisiciones Conjuntas del Fondo Mundial.
- Recibir los medicamentos bajo la modalidad de donación.
- Cualquier otra alternativa que ustedes consideren que pueda generar las coberturas de atención planteadas en el proyecto y las cuales se planean mediante la adquisición de los medicamentos en forma escalonada y en las cantidades que se relacionan a continuación:
Tabla 11.
| Medicamento | Presentación | Año 2023 (unidades) | Año 2024 (unidades) | Año 2025 (unidades) | Total (unidades) |
| DTG / Dolutegravir | 50 mg tablet 30 | 9.927 | 12.519 | 15.129 | 37.575 |
(…)”.
3. Luego de múltiples recordatorios y pese a la urgente situación planteada, la “Market Access Lead for Emerging Markets” contestó el 6 de diciembre de 2022 lo siguiente:
“En relación a su apreciada comunicación, deseamos informarle que luego de la discusión del Foro Global la compañía considera que debemos buscar una solución alternativa a la donación que pueda ser sostenible en el tiempo y logre cubrir las necesidades de la población migrante venezolana. En consecuencia, nuestro equipo tanto en Colombia como de la región internacional ya ha iniciado contactos con organizaciones locales y supranacionales para desarrollar una alternativa que provea sustentabilidad en el tratamiento y atención integral en salud de la población migrante venezolana viviendo con VIH.
Somos conscientes de la urgencia de la solicitud y esperamos retornar a ustedes con una propuesta a la mayor brevedad posible”.
4. Posterior a esta respuesta, no se recibió correo o comunicación alguna por parte de ViiV Healthcare o de GlaxoSmithKline Colombia S. A.
5. Pese a los anterior, y con el objetivo de seguir explorando la posibilidad de obtener una licencia voluntaria para el país, se llevó a cabo un acercamiento con el Medicines Patent Pool (MPP), el cual es una organización de salud pública respaldada por las Naciones Unidas, fundada por Unitaid en el año 2010, que tiene por objetivo mejorar el acceso a medicamentos esenciales asequibles y apropiados en los países de ingreso mediano y bajo.
6. El Medicines Patent Pool negocia con los titulares de las patentes, licencias sobre medicamentos esenciales principalmente en el campo del VIH, la hepatitis C y la tuberculosis para que los países explícitamente determinados por el titular en el contrato puedan acceder a licencias voluntarias para la fabricación o importación de los medicamentos genéricos objeto de dicha licencia.
7. Tras revisar la información disponible de licencias voluntarias del MPP, se encontró que Colombia solo está incluido en la licencia obligatoria del Dolutegravir (DTG) para su presentación para uso pediátrico44, pero el país NO es beneficiario de la licencia voluntaria para la presentación para uso en adultos45.
8 Adicionalmente, este Ministerio llevó a cabo una reunión con el MPP el 24 de febrero de 2023 en la cual esta situación fue ratificada.
Atendiendo la situación fáctica expuesta, en este caso la licencia obligatoria es una medida adecuada para alcanzar el fin que se busca, esto es, atender la situación de salud pública generada a raíz de la infección por VIH, en razón a que habilitaría legalmente el acceso al medicamento genérico Dolutegravir para tratar en primera y segunda línea la enfermedad.
El acceso al medicamento genérico no sería viable jurídicamente sin la licencia obligatoria, a menos que mediara la autorización del titular de la patente, cuya negociación fracasó de acuerdo con la información suministrada por el MSPS.
5.1.4. Identificación de las patentes sobre las composiciones farmacéuticas cuyo principio activo es el Dolutegravir que deberían ser licenciadas
Que de acuerdo con la Resolución 881 del 2 de junio de 2023, se identificaron cuatro (4) patentes sobre las composiciones farmacéuticas cuyo principio activo es el Dolutegravir:
Tabla 12. Relación de patentes identificadas en Resolución 881 de 2023.
| NÚMERO DE CONCESIÓN | NÚMERO DE PATENTE | TÍTULO | TITULAR |
| 6085 | 12125933 | Composición farmacéutica que comprende la combinación de dolutegravir, abacavir y lamivudina o sales farmacéuticamente aceptables de los mismos | VIIV HEALTHCARE COMPANY |
| 32255 | 14085830 | Composiciones farmacéuticas que comprenden dolutegravir y rilpivirina con actividad antiviral para VIH | VIIV HEALTHCARE COMPANY |
| 1886 | 07115501 | Derivado de carbamoilpiridona policíclico que tiene actividad inhibidora de la integrasa del VIH | VIIV HEALTHCARE COMPANY |
| 1887 | 07115501A | Derivado de carbamoilpiridona policíclico que tiene actividad inhibidora de la integrasa del VIH | - VIIV HEALTHCARE COMPANY - SHIONOGI & CO. LTDA. |
Que no obstante, el Comité Técnico Interinstitucional recomienda limitar la declaratoria a las siguientes dos (2) patentes:
Tabla 13. Relación de patentes relacionadas en el informe de recomendaciones.
| NÚMERO DE CONCESIÓN | NÚMERO DE PATENTE | TÍTULO | TITULAR |
| 1886 | 07115501 | Derivado de carbamoilpiridona policíclico que tiene actividad inhibidora de la integrasa del VIH | VIIV HEALTHCARE COMPANY |
| 1887 | 07115501A | Derivado de carbamoilpiridona policíclico que tiene actividad inhibidora de la integrasa del VIH | - VIIV HEALTHCARE COMPANY - SHIONOGI & CO. LTDA. |
Que atendiendo a que en el informe de recomendaciones se evidenció que el esquema de tratamiento requerido para atender la situación de interés público es “tenofovir + lamivudina+ dolutegravir”, se manifiesta que para el actual procedimiento de declaratoria no se requiere someter a licencia obligatoria las patentes 12125933 “Composición farmacéutica que comprende la combinación de dolutegravir, abacavir y lamivudina o sales farmacéuticamente aceptables de los mismos” y 14085830 “Composiciones farmacéuticas que comprenden dolutegravir y rilpivirina con actividad antiviral para VIH”.
Que, de igual manera, teniendo en cuenta que la Superintendencia de Industria y Comercio señaló que la fórmula del compuesto Dolutegravir no corresponde con los compuestos definidos y protegidos mediante las reivindicaciones 1 y 2 de la solicitud de patente número 07115501 y que dicho compuesto está comprendido dentro del alcance de la protección conferida por la patente 07115501A, esta será la patente sobre la que se declarará la existencia de razones de interés público.
5.1.5. Medidas o mecanismos necesarios que se deban adoptar para conjurar dicha afectación
Con el ánimo de conjurar la afectación expuesta en el presente acto administrativo, se deberá declarar la existencia de razones de interés público para someter la patente señalada en el punto 5.1.4. de esta resolución, a licencia obligatoria en la modalidad de uso gubernamental, prevista como una medida proporcional para lograr el fin de salud pública que se busca.
Con la concesión de la licencia obligatoria en la modalidad de uso gubernamental, se realizará la importación y disponibilidad del medicamento genérico, que permitiría ofrecer el tratamiento recomendado a i) población migrante venezolana (regular e irregular); ii) personas que viven con VIH recién diagnosticadas; iii) personas con falla virológica y iv) personas que requieren profilaxis postexposición que según la evidencia y análisis presentados por el Ministerio de Salud y Protección Social, requerirán en primera medida el dolutegravir, para así evitar un impacto mayor en el comportamiento de la epidemia a nivel nacional.
Que en cumplimiento de los principios al debido proceso, transparencia, imparcialidad, participación, publicidad, y por tratarse de un proceso de declaratoria de existencia de razones de interés público, toda la información relativa a la actuación administrativa de declaratoria está públicamente disponible en la página web del Ministerio de Salud y Protección Social.
Que una vez este despacho ha revisado y valorado los documentos que le han sido remitidos, cuenta con suficientes razones que justifican la presente decisión.
En mérito de lo expuesto,
RESUELVE:
ARTÍCULO 1o. OBJETO. Declarar la existencia de razones de interés público para someter la patente 07115501A del medicamento Dolutegravir a licencia obligatoria en la modalidad de uso gubernamental, de conformidad con lo reglamentado en el Capítulo 24 del Decreto 1074 de 2015, Único Reglamentario del Sector Comercio Industria y Turismo.
ARTÍCULO 2o. NOTIFICACIONES. Notificar el contenido de la presente resolución a los titulares de la patente y a los titulares de registro sanitario de los medicamentos contentivos del principio activo VIIV HEALTHCARE COMPANY, SHIONOGI & CO. LTD. y GLAXOSMITHKLINE COLOMBIA S. A.
ARTÍCULO 3o. COMUNICACIÓN DEL PROCEDIMIENTO ADMINISTRATIVO. Comunicar la presente resolución a los terceros interesados que intervinieron en el procedimiento administrativo.
ARTÍCULO 4o. COMUNICACIÓN PARA EL TRÁMITE DE LICENCIAS OBLIGATORIAS. Comunicar la presente resolución a la Superintendencia de Industria y Comercio para proceder con lo de su competencia, de conformidad con el artículo 2.2.2.24.7 del Decreto 1074 de 2015.
ARTÍCULO 5o. PUBLICIDAD DEL PROCEDIMIENTO ADMINISTRATIVO. Ordenar la publicación del presente acto administrativo en el Diario Oficial y en la página web del Ministerio de Salud y Protección Social, de conformidad con lo previsto en el numeral 6 del artículo 2.2.2.24.4 del Decreto 1074 de 2015.
ARTÍCULO 6o. RECURSOS. Contra la presente resolución procede el recurso de reposición, el cual podrá ser interpuesto dentro de los diez (10) días siguientes a su notificación de conformidad con lo previsto en el artículo 74 de la Ley 1437 de 20
ARTÍCULO 7o. VIGENCIA. La presente resolución rige a partir de su ejecutoria.
Notifíquese, comuníquese, publíquese y cúmplase.
Dada en Bogotá, D. C., a 2 de octubre de 2023.
El Ministro de Salud y Protección Social,
Guillermo Alfonso Jaramillo Martínez
NOTAS AL FINAL:
1. Marta Franch i Saguer: “La idea del interés público nace como sustituto de la noción de “bien común”. en: La ética pública del derecho administrativo” p. 406.
2. Jorge Correa Fontecilla; “Algunas consideraciones sobre el interés público en la Política y el Derecho” p. 159. Recuperado de: https://dialnet.unirioja.es/descarga/articulo/2254414.pdf -
3. Ibídem.
4. ONU: Asamblea General, Pacto Internacional de Derechos Civiles y Políticos. Adoptado y abierto a la firma, ratificación y adhesión por la Asamblea General en su Resolución 2200 A (XXI), del 16 de diciembre de 1966, 16 diciembre 1966, Naciones Unidas, Serie de Tratados, vol. 999, p. 171.
5. Corte Constitucional. Sentencia C-811 de 2007. M. P.: Mauricio González Cuervo.
6. Ibídem.
7. Artículo 13. (…) El Estado protegerá especialmente a aquellas personas que por su condición económica, física o mental, se encuentren en circunstancia de debilidad manifiesta y sancionará los abusos o maltratos que contra ellas se cometan. (…)”. Negrilla fuera del texto original.
8. Corte Constitucional. Sentencia T-228 de 2013. M. P.: Nilson Pinilla Pinilla.
9. Organización Panamericana de la Salud, El acceso a los medicamentos de alto costo en las Américas: contexto, desafíos y perspectivas. Serie Técnica No. 1 Medicamentos esenciales, acceso, e innovación. (2009) Washington, DC: OPS. Consultado el 3 de octubre de 2021 https://www.paho.org/hq/ dmdocuments/2009/Acceso-alto-costo-Inf-Tec-1-Oct-5-2009.pdf
10. Corte Constitucional. Sentencia T-228 de 2013. M. P.: Nilson Pinilla Pinilla.
11. Ministerio de Salud. (2022). Colombia llegó al aseguramiento universal en salud al alcanzar el 99,6 %.Recuperado de: https://www.minsalud.gov.co/Paginas/Colombia-llego-al-aseguramiento-universal-en-salud-al-alcanzar-el-99.6.aspx
12. Acuerdo sobre los ADPIC: Visión General (s. f.). Recuperado de https://www.wto.org/spanish/ tratop_s/trips_s/intel2_s.htm#:~:text=El%20Acuerdo%20sobre%20los%20ADPIC%20es%20un%20 acuerdo%20de%20normas,sus%20sistemas%20y%20usos%20jur%C3%ADdicos
13. Normas relativas a la existencia, alcance y ejercicio de los derechos de propiedad intelectual. Recuperado de la página de consulta pública: https://www.wto.org/spanish/docs_s/legal_s/31bis_ trips_04c_s.htm
14. ONUSIDA, (s.f.). Aprovechar las flexibilidades de los ADPIC para mejorar el acceso al tratamiento del VIH. Recuperado de https://unaids-test.unaids.org/sites/default/files/unaids/contentassets/documents/ unaidspublication/2011/JC2049_PolicyBrief_TRIPS_es.pdf
15. Comunidad Andina de Naciones. Decisión 486 de 2000. Disponible en: https://propiedadintelectual. unal.edu.co/fileadmin/recursos/innovacion/docs/normatividad_pi/decision486_2000.pdf
16. Organización Mundial del Comercio (OMC). Explicación de la Declaración de Doha relativa a los ADPIC. Disponible en: https://www.wto.org/spanish/tratop_s/trips_s/healthdeclexpln_s.htm
17. Comunidad Andina de Naciones. Decisión 486 de 2000. Régimen Común sobre Propiedad Industrial. Disponible en: https://propiedadintelectual.unal.edu.co/fileadmin/recursos/innovacion/docs/ normatividad_pi/decision486_2000.pdf.
18. Tribunal Andino de Justicia. Interpretación prejudicial 144-IP-2019. 16 de marzo de 2021. Disponible en: https://www.comunidadandina.org/DocOficialesFiles/Procesos/144_IP_2019.pdf
19. Lo anterior, de acuerdo con el Tribunal Andino de Justicia (144IP2019), sujeto a una justificación adecuada y suficiente las razones de interés público, de las circunstancias particulares del caso, y del porqué de la necesidad de adoptar dicha medida a partir de la aplicación del test de razonabilidad. Nota al pie visible en la página 12.
20. T- John R. Thomas, Compulsory Licensing of Patented Inventions, Cong. Res. Serv., R43266, January 14, 2014; Colleen Chien, Cheap Drugs at What Price to Innovation: Does the Compulsory Licensing of Pharmaceuticals Hurt Innovation?, 18 Berkeley Tech. L. J. 853 (2003). Recuperado de la página de consulta pública https://www.southcentre.int/wp-content/uploads/2018/06/RP85-Acceso-a-medicamentos_-licencias-obligatorias-y-uso-gubernamental_Hep-C.pdf.
21. Ibídem.
22. Ib.
23. Correa, Carlos. Innovación Farmacéutica, patentes incrementales y licencias obligatorias. South Centre. Recuperado de la página de consulta pública https://www.southcentre.int/wp-content/uploads/2013/05/ RP41_Pharmaceutical-Innovation_ES.pdf
24. Catalina de la Puente, Gastón Palopoli, Constanza Silvestrini, Juan Correa. Experiencias internacionales sobre la concesión de licencias obligatorias por razones de salud pública. South Center 2023
25. Catalina de la Puente, Gastón Palopoli, Constanza Silvestrini, Juan Correa. Experiencias internacionales sobre la concesión de licencias obligatorias por razones de salud pública. South Center 2023.
26. Óscar Andrés Lizarazo Cortés - Profesor Asociado. Planta - Tiempo Completo - Director Grupo de Investigación Plebio - Facultad de Derecho - Universidad Nacional de Colombia.
27. Esta observación al informe de recomendaciones del Comité Técnico Interinstitucional, fue presentada por el profesor Óscar Andrés Lizarazo Cortés el 20 de septiembre de 2023. La observación se encuentra para consulta de la ciudadanía.
28. Artículo 61 https://propiedadintelectual.unal.edu.co/fileadmin/recursos/innovacion/docs/ normatividad_pi/decision486_2000.pdf.
29. Obligaciones y excepciones. Recuperado de https://www.wto.org/spanish/tratop_s/trips_s/factsheet_ pharm02_s.htm.
30. Ibídem.
31. Organización Mundial del Comercio (OMC). Explicación de la Declaración de Doha relativa a los ADPIC. Disponible en: https://www.wto.org/spanish/tratop_s/trips_s/healthdeclexpln_s.htm.
32. ONUSIDA, (s. f.). Aprovechar las flexibilidades de los ADPIC para mejorar el acceso al tratamiento del VIH. Recuperado de https://unaids-test.unaids.org/sites/default/files/unaids/contentassets/documents/ unaidspublication/2011/JC2049_PolicyBrief_TRIPS_es.pdf.
33. Ibídem.
34. Recuperado. https://www.unaids.org/es/resources/presscentre/pressreleaseandstatementarchive/2023/ june/20230612_colombia-hiv-treatment.
35. Roa Ortiz, Cristian Camilo. 2021. Utilidad de las licencias obligatorias para el acceso a medicamentos: Lecciones de Suramérica y análisis del caso colombiano. Recuperado del documento público: https:// revistas.uexternado.edu.co/index.php/propin/article/view/7269/10182.
36. Alemania “BGH grants compulsory license in preliminary proceedings” https://ipkitten.blogspot. com/2017/07/bgh-grants-compulsory-license-in.html.
37. Al respecto, la observación del profesor Óscar Lizarazo, permite ahondar en el caso de Alemania como un ejemplo de la ausencia de afectación en la innovación e inversión por el uso de licencias obligatorias.
38. Israel https://www.keionline.org/32503.
39. Instituto Nacional de Salud, Informes de evento VIH, años 2018 a 2022.
40. Joint United Nations Programme on HIV/AIDS (UNAIDS). The Path That Ends AIDS. 2023 UNAIDS GLOBAL AIDS UPDATE [consultado 22 de agosto de 2023. Available from: https://thepath.unaids. org/wp-content/themes/unaids2023/assets/files/2023_report.pdf.
41. Una epidemia generalizada se define como aquella que se sostiene por sí sola a través de la transmisión heterosexual. ONUSIDA.
42. Organización Mundial de la Salud, Organización Panamericana de la Salud y Programa Conjunto de las Naciones Unidas sobre el VIH/Sida. Pautas para la Vigilancia de Infecciones de Transmisión Sexual. 1999. Disponible en: https://apps.who.int/iris/bitstream/handle/10665/67818/WHO_CHS_ HSI_99.2_spa.pdf?sequence=1&isAllowed=y.
43. Organización Mundial de la Salud/Organización Panamericana de la Salud. Epidemia del VIH y respuesta en América Latina y el Caribe. Octubre 2022. Disponible en: https://www.paho.org/es/ documentos/epidemia-vih-respuesta-america-latina-caribe-octubre-2022.
44. Uribe Arbeláez, Martín. Impatentabilidad de medicamentos esenciales. Recuperado de https://revistas. uexternado.edu.co/index.php/propin/article/view/3907/4201
45. Ibídem.
46. Ibídem.
47. Obligaciones y excepciones. Recuperado de la página de consulta pública https://www.wto.org/ spanish/tratop_s/trips_s/factsheet_pharm02_s.htm.
48. Artículos 177 y 178 de la Ley 100 de 1993.
49. Parágrafo 5. El Comité elaborará un informe de recomendación y lo pondrá a disposición del peticionario, del titular de la patente, de las autoridades públicas pertinentes y de cualquier tercero interesado para que en el término de diez (10) días hábiles presenten observaciones. Vencido este término dentro de los tres (3) días hábiles siguientes, el Comité remitirá a la autoridad competente, el informe de recomendación y las observaciones presentadas, si las hubiere.
50. Catalina de la Puente, Gastón Palopoli, Constanza Silvestrini, Juan Correa. Experiencias internacionales sobre la concesión de licencias obligatorias por razones de salud pública. South Center 2023.
51. Red Somos, Ministerio de Salud y Protección Social y Universidad Johns Hopkins. Encuesta bioconductual sobre el VIH, la sífilis y el estado de salud de los venezolanos que viven en Colombia. Informe final. Bogotá y Baltimore. Octubre de 2022 Disponible en: https://share-netcolombia.org/ documentos/INFORME_FINAL_BIENVENIR.pdf
52. Una epidemia generalizada se define como aquella que se sostiene por sí sola a través de la transmisión heterosexual. ONUSIDA.
53. Organización Mundial de la Salud, Organización Panamericana de la Salud y Programa Conjunto de las Naciones Unidas sobre el VIH/Sida. Pautas para la Vigilancia de Infecciones de Transmisión Sexual. 1999. Disponible en: https://apps.who.int/iris/bitstream/handle/10665/67818/WHO_CHS_ HSI_99.2_spa.pdf?sequence=1&isAllowed=y
54. Fuente de consulta pública: data-book-ONUSIDA_2022.pdf
55. Ministerio de Salud y Protección Social. Resolución 518 de 2015 “Por la cual se dictan disposiciones en relación con la Gestión de la Salud Pública y se establecen directrices para la ejecución, seguimiento y evaluación del Plan de Salud Pública de Intervenciones Colectivas (PIC)”.
56. Ministerio de Salud y Protección Social. Resolución 3280 de 2018 “Por medio de la cual se adoptan los lineamientos técnicos y operativos de la Ruta Integral de Atención para la Promoción y Mantenimiento de la Salud y la Ruta Integral de Atención en Salud para la Población Materno Perinatal y se establecen las directrices para su operación”.
57. ENTerritorio, número de personas con una prueba reactiva de VIH reportadas al SISCO SSR, proyecto VIH del Fondo Mundial de Lucha contra el Sida, la tuberculosis y la malaria, años 2019 a 2022. Consultado 11 de agosto de 2023 en: https://app.powerbi.com/view?r=eyJrIjoiNGFjOTk0YzktMGY0Yi 0 0 N z l k L T l i M G Q t M W E5OGZjMzZmNjk2Iiw i d C I 6 I j E 5 Z m EzZWY4LTEwMjAtNGFiMy04YWUzLTRjZWZjZWRiYmVmOSIsImMiOjR9.
58. Proyecto para la ampliación de la Respuesta Nacional al VIH con Enfoque de Vulnerabilidad en Colombia. Autotest de VIH - otra opción para cuidarte.
59. Recuperado de la página de consulta pública: https://www.minsalud.gov.co/sites/rid/Lists/ BibliotecaDigital/RIDE/VS/PP/lineamiento-profilaxis-preesposicion-vih-prep.pdf.
60. Instituto Nacional de Salud, Informes de evento VIH, años 2018 a 2022
61. Instituto Nacional de Salud. Informes del comportamiento en la notificación del evento de VIH, 2018 a 2022. Disponibles en: https://www.ins.gov.co/buscador-eventos/Paginas/Info-Evento.aspx
62. Red Somos, Ministerio de Salud y Protección Social y Universidad Johns Hopkins. Encuesta bioconductual sobre el VIH, la sífilis y el estado de salud de los venezolanos que viven en Colombia. Informe final. Bogotá y Baltimore. Octubre de 2022 Disponible en: https://share-net-colombia.org/ documentos/INFORME_FINAL_BIENVENIR.pdf
63. SPECTRUM es un conjunto de modelos fáciles de usar que brindan a los formuladores de políticas una herramienta analítica para respaldar el proceso de toma de decisiones. https://www.avenirhealth.org/ software-spectrum.php
64. Asumiendo que en el país hay 180.000 personas viviendo con VIH, los porcentajes de la cascada de atención a partir de los datos de la cuenta de alto costo son: 78,8% conocen su diagnóstico, de ellos 88,3% inician tratamiento, y de estos 78,1% tiene carga viral indetectable.
65. Cuenta de Alto Costo (CAC), Fondo Colombiano de Enfermedades de Alto Costo, Cuenta de Alto Costo (CAC). Situación del VIH en Colombia, 2022; Bogotá, D.C., 2023.
66. Clinical Info HIV gov. Glossary of HIV/AIDS-Related Terms 2021 - 9TH EDITION Offering information on HIV/AIDS treatment, prevention, and research. Disponible en https://clinicalinfo.hiv. gov/sites/default/files/glossary/Glossary-English_HIVinfo.pdf
67. Directrices sobre la respuesta de salud pública a la farmacorresistencia del VIH previa al tratamiento. Julio 2017. Washington, D.C.: Organización Panamericana de la Salud; 2019. Licencia: CC BY-NCSA 3.0 IGO. Pág. 28
68. Organización Panamericana de la Salud. Actualización sobre la transición al tratamiento antirretroviral basado en Dolutegravir. Informe de una reunión de la OMS, 29 y 30 de marzo del 2022. Washington, DC: OPS; 2023. Disponible en: https://doi.org/10.37774/9789275327081. Pág. 7
69. Actualización de recomendaciones sobre esquemas antirretrovirales de primera y segunda línea. Ginebra, Suiza: Organización Mundial de la Salud; 2019 (OMS/CDS/VIH/19.15)
70. Organización Panamericana de la Salud. Actualización sobre la transición al tratamiento antirretroviral basado en Dolutegravir
71. OMS (2021). La OMS publica el informe de 2021 sobre la farmacorresistencia del VIH. https://www. who.int/es/news/item/24-11-2021-who-releases-hiv-drug-resistance-report-2021#:~:text=La%20 OMS%20recomienda%20desde%202019,otros%20medicamentos%20actualmente%20en%20uso
72. S. Gualtero, et al. Inhibidores de Transferencia de la Cadena de Integrasa: Bases para su uso en la práctica clínica. Infectio 2019; 23(S1): 98-120
73. Informe de recomendaciones del Comité Técnico Institucional sobre la declaración de interés público de los medicamentos cuyo principio activo es el Dolutegravir con fines de licencia obligatoria. Año 2023
74. Anexo 6.5 de la GPC Colombia 2021, el cual contiene las tablas de síntesis de evidencia GRADE y las calificaciones de certeza de la evidencia para cada desenlace crítico, se encuentra que hubo desenlaces como mayor probabilidad de carga viral indetectable a diferentes tiempos de seguimiento con Dolutegravir vs otros medicamentos con certeza de la evidencia alta
75. Ministerio de Salud y Protección Social, Empresa Nacional Promotora del Desarrollo Territorial e Instituto de Evaluación Tecnológica en Salud. Guía de Práctica Clínica basada en la evidencia científica para la atención de la infección por VIH/SIDA en personas adultas, gestantes y adolescentes. Versión completa. Bogotá D. C. Colombia; 2021.
76. Guía de práctica clínica VIH 2021
77. World Health Organization. CONSOLIDATED GUIDELINES ON HIV PREVENTION, TESTING, TREATMENT, SERVICE DELIVERY AND MONITORING: RECOMMENDATIONS FOR A PUBLIC HEALTH APPROACH. JULY 2021. Disponible en: https://www.who.int/publications/i/ item/9789240031593
78. Ministerio de Salud y Protección Social, Empresa Nacional Promotora del Desarrollo Territorial e Instituto de Evaluación Tecnológica en Salud. Guía de Práctica Clínica basada en la evidencia científica para la atención de la infección por VIH/SIDA en personas adultas, gestantes y adolescentes. Versión completa. Bogotá D.C. Colombia; 2021
79. World Health Organization. Consolidated guidelines on hiv prevention, testing, treatment, service delivery and monitoring: recommendations for a public health approach. July 2021. Disponible en: https://www.who.int/publications/i/item/9789240031593
80. Declaración Conjunta de la VIII Reunión Técnica Internacional sobre Movilidad Humana de Personas Venezolanas en la Región año 2022. Disponible en: https://www.procesodequito.org/sites/g/files/ tmzbdl466/files/2022-07/DECLARACI%C3%93N%20CONJUNTA%20CAP%C3%8DTULO%20 BRASILIA.%20ESPA%C3%91OL.pdf
81. Comunicaciones Resolución 881 de 2023. ONUSIDA, página 13. Disponible: https://www.minsalud. gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/MET/comunicaciones-resolucion-881-de-2023.pdf
82. Propuesta para incrementar la cobertura de salud de las personas refugiadas y migrantes con VIH de la República Bolivariana de Venezuela año 2021. Disponible en: https://iris.paho.org/bitstream/ handle/10665.2/54912/OPSONUSIDACDECOVID-19210013_spa.pdf?sequence=1&isAllowed=y.
83. Ibidem.
84. Organización Mundial de la Salud/Organización Panamericana de la Salud. Epidemia del VIH y respuesta en América Latina y el Caribe. Octubre 2022. Disponible en:
https://www.paho.org/es/documentos/epidemia-vih-respuesta-america-latina-caribe-octubre-2022
85. Cuenta de Alto Costo (CAC) Fondo Colombiano de Enfermedades de Alto Costo. Situación del VIH en Colombia 2022 Bogotá D.C., 2023.
86. Consenso basado en la evidencia de indicadores mínimos para evaluar la gestión del riesgo de las personas viviendo con el VIH atendidas en el marco del Sistema de Salud Colombiano (actualización 2023).
88. Ministerio de Salud y Protección Social. basada en la evidencia científica para la atención de la infección por VIH/SIDA en personas adultas, gestantes y adolescentes. Versión completa. Bogotá, D. C., Colombia; 2021.
Las notas de vigencia, concordancias, notas del editor, forma de presentación y disposición de la compilación están protegidas por las normas sobre derecho de autor. En relación con estos valores jurídicos agregados, se encuentra prohibido por la normativa vigente su aprovechamiento en publicaciones similares y con fines comerciales, incluidas -pero no únicamente- la copia, adaptación, transformación, reproducción, utilización y divulgación masiva, así como todo otro uso prohibido expresamente por la normativa sobre derechos de autor, que sea contrario a la normativa sobre promoción de la competencia o que requiera autorización expresa y escrita de los autores y/o de los titulares de los derechos de autor. En caso de duda o solicitud de autorización puede comunicarse al teléfono 617-0729 en Bogotá, extensión 101. El ingreso a la página supone la aceptación sobre las normas de uso de la información aquí contenida.