



CIRCULAR EXTERNA 7 DE 2015
(febrero 26)
Diario Oficial No. 49.438 de 27 de febrero de 2015
MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL
<NOTA DE VIGENCIA: Circular derogada en lo que respecta a las acciones programáticas de prevención y control de la tuberculosis por el artículo 6 de la Resolución 227 de 2020>
| Para: | Gobernadores, Alcaldes, Entidades Territoriales de Salud Departamentales, Distritales y Municipales, Instituciones Prestadoras de Servicios de Salud Públicas y Privadas, Entidades Administradoras de Planes de Beneficios de Régimen Contributivo, Subsidiado y de Excepción y Entidades Adaptadas. |
| De: | Ministro de Salud y Protección Social |
| Asunto: | Actualización de los Lineamientos para el Manejo Programático de Tuberculosis y Lepra en Colombia |
En desarrollo a las disposiciones legales contenidas en las Leyes 100 de 1993, artículo 173 numeral 2, 715 de 2001 artículo 42, numerales 1, 3 y 6; 1438 de 2011, los Decretos 2323 de 2006 y 3518 de 2006; las Resoluciones 412 de 2000 y 1841 de 2013 y las Circulares Externas 058 de 2009 y 01 de 2013, en el marco de las competencias señaladas en el Decreto 4107 de 2011, y en ejercicio de sus funciones de rectoría, dirección, orientación y conducción del sector salud, el Ministerio de Salud y Protección Social establece ajustes a los lineamientos actuales para el manejo programático de Tuberculosis y Lepra, con el fin de fortalecer algunos aspectos operativos del programa de prevención y control de dichas enfermedades, en los siguientes términos:
Primero. Adoptar las nuevas definiciones programáticas para Tuberculosis formalizadas en 2013 por la Organización Mundial de la Salud (OMS), de conformidad con el Anexo 1 que hace parte integral del presente acto.
Segundo. Actualizar los esquemas de tratamiento contenidos en la Guía de Atención Integral de Tuberculosis Pulmonar y Extrapulmonar definidas en la Resolución 412 de 2000, así como los establecidos en el numeral 5 de la Circular Externa 058 de 2009, de conformidad con los Anexo 2 y 3 que hace parte integral del presente acto.
Tercero. Proveer directrices técnicas para la implementación de las acciones colaborativas TB/VIH, de conformidad con el Anexo 4 que hace parte integral del presente acto.
Cuarto. El Instituto Nacional de Salud (INS), a través de los protocolos de vigilancia de Tuberculosis y Lepra, divulgará periódicamente los lineamientos y algoritmos para el uso de pruebas de susceptibilidad a fármacos.
Quinto. Proveer directrices técnicas para la implementación de las acciones colaborativas TB/VIH (Anexo 5. Actividades colaborativas TB/VIH).
Por lo anterior, el Ministerio de Salud y Protección Social insta a todos los integrantes del Sistema General de Seguridad Social en Salud (SGSSS), a adoptar e implementar los lineamientos contenidos en los anexos técnicos que hacen parte integral de la presente Circular, como instrumento técnico y científico de apoyo al fortalecimiento de la gestión técnica a los Programas Departamentales, Distritales y Municipales de Prevención y Control de Tuberculosis y Lepra.
Publíquese y cúmplase.
Dada en Bogotá, D. C., a 26 de febrero de 2015.
ALEJANDRO GAVIRIA URIBE.
DEFINICIONES PROGRAMÁTICAS PARA TUBERCULOSIS ADAPTADAS DEL DOCUMENTO “DEFINITIONS AND REPORTING FRAMEWORK FOR TUBERCULOSIS” ACTUALIZADO EN DICIEMBRE DE 2014.
DEFINICIONES
Las nuevas definiciones que a continuación se presentan son la adaptación del documento “Definitions and reporting framework for tuberculosis – 2013 (actualizado en diciembre de 2014)” publicado por la Organización Mundial de la Salud.
1. Definiciones de caso por ingreso a tratamiento:
Caso de TB bacteriológicamente confirmado: Es aquel con muestra biológica positiva por baciloscopia, cultivo o prueba molecular.
Caso de TB clínicamente diagnosticado: Es aquel caso que no cumple con los criterios para la confirmación bacteriológica, pero ha sido diagnosticado con tuberculosis activa por un médico, quien ha decidido dar al paciente un ciclo completo de tratamiento antituberculosis. Esta definición incluye casos diagnosticados sobre la base de anomalías de rayos X y/o histopatología sugestiva y/o tiene nexo epidemiológico (contacto con un caso de tuberculosis confirmado).
Si estos casos clínicamente diagnosticados posteriormente resultan ser bacteriológicamente positivos (antes o después de comenzar el tratamiento) deben ser reclasificados como bacteriológicamente confirmados.
Todos estos casos deben ser notificados al Sivigila y al Programa de TB. A su vez deben ser ingresados al libro de pacientes, ingresados en los informes programáticos y evaluados en la cohorte, independientemente si inició tratamiento o no.
Los casos bacteriológicamente confirmados o clínicamente diagnosticados de TB también se clasifican por:
-- Localización anatómica de la enfermedad;
-- Historia de tratamiento previo;
-- Resistencia a los medicamentos;
-- Condición de VIH.
2. Clasificación basada en la localización anatómica de la enfermedad
a) Tuberculosis pulmonar (TBP). Se refiere a cualquier caso bacteriológicamente confirmado o clínicamente diagnosticado de TB, que implica el parénquima pulmonar o el árbol traqueo bronquial. La TB miliar se clasifica como TBP porque hay lesiones en los pulmones. Las Linfoadenopatías tuberculosas intratoráxicas (mediastínicas y/o hiliares) o derrame pleural tuberculoso, sin alteraciones radiológicas en los pulmones, constituye un caso de TB extrapulmonar;
b) Tuberculosis extrapulmonar (TBE): Se refiere a cualquier caso bacteriológicamente confirmado o clínicamente diagnosticado de TB que involucra otros órganos que no sean los pulmones, por ejemplo, pleura, ganglios linfáticos, abdomen, tracto genitourinario, piel, articulaciones, huesos y meninges.
Un paciente con TB pulmonar y extrapulmonar debe notificarse y clasificarse como un caso de TBP.
3. Clasificación basada en la historia de tratamiento de TB previo
a) Paciente nuevo: Paciente que nunca ha sido tratado por TB o que ha recibido medicamentos antiTB por menos de un mes;
b) Paciente previamente tratado: Paciente que ha recibido 1 mes o más de los medicamentos antiTB en el pasado. Se clasifica además por los resultados de su más reciente ciclo de tratamiento (ver Tabla 1) de la siguiente manera:
i) Tras Recaída: Paciente que ha sido previamente tratado por TB, fue declarado curado o tratamiento terminado al final de su último ciclo de tratamiento, y ahora es diagnosticado con un episodio recurrente de TB (ya sea una verdadera recaída o un nuevo episodio de TB causado por reinfección).
ii) Tras Fracaso: Paciente previamente tratado por TB, cuyo tratamiento fracasó (ver definición de fracaso).
iii) Recuperado tras pérdida de seguimiento: Paciente que ha sido tratado previamente por TB y declarado pérdida al seguimiento al final de su tratamiento más reciente.
iv) Otros pacientes previamente tratados: Son aquellos que han sido previamente tratados por TB, pero cuyo resultado después del tratamiento más reciente es desconocido o indocumentado.
4. Clasificación basada en el estado de VIH
a) Paciente con TB y VIH: Se refiere a cualquier caso bacteriológicamente confirmado o clínicamente diagnosticado de TB y que tienen un resultado positivo de la prueba del VIH realizado al momento del diagnóstico de TB u otra evidencia documentada de inscripción a la atención de VIH, tales como la inscripción en el registro de preTARV o en el registro de TARV una vez que el TARV se ha iniciado;
b) Paciente con TB y sin VIH: Se refiere a cualquier caso bacteriológicamente confirmado o clínicamente diagnosticado de TB y que tiene un resultado negativo de la prueba del VIH realizada al momento del diagnóstico de la TB. Cualquier paciente con TB y sin VIH que posteriormente se encuentra que tiene VIH debe ser reclasificado;
c) Paciente con TB y estado de VIH desconocido: Se refiere a cualquier caso bacteriológicamente confirmado o clínicamente diagnosticado de TB que no tiene ningún resultado de la prueba del VIH y no hay otra evidencia documentada de inscripción a la atención del VIH. Si posteriormente se determina el estado de VIH del paciente, este debe ser reclasificado.
5. Clasificación basada en la resistencia a medicamentos
a) Monorresistencia: Resistencia a solo un medicamento antiTB de primera línea;
b) Polirresistencia: Resistencia a más de un medicamento de primera línea antiTB (que no sea Isoniazida y Rifampicina a la vez);
c) Multidrogorresistencia: Resistencia al menos a la Isoniazida y la Rifampicina;
d) Extensamente resistente: Resistencia a cualquier fluoroquinolona y al menos uno de los tres medicamentos inyectables de segunda línea (Capreomicina, Kanamicina y Amikacina), en casos con multidrogorresistencia;
e) Resistencia a la Rifampicina: Detectada utilizando métodos fenotípicos y genotípicos, con o sin resistencia a otros medicamentos antiTB. Incluye cualquier resistencia a la Rifampicina, ya sea monorresistencia, multidrogorresistencia, polirresistencia o extensamente resistente.
Estas categorías no son todas mutuamente excluyentes. Al enumerar la TB resistente a la Rifampicina (TB-RR), por ejemplo, también se incluyen la tuberculosis multidrogorresistente (TB-MDR) y la tuberculosis extensamente resistente (TB-XDR). A pesar de la práctica actual de limitar las definiciones de monorresistencia y polirresistencia solo a fármacos de primera línea, los futuros esquemas de medicamentos pueden hacer importante clasificar a los pacientes por los patrones de resistencia de sus cepas a las fluoroquinolonas, los inyectables de segunda línea y cualquier otro medicamento antiTB para los que haya disponibilidad de PSF confiable.
6. Definiciones de caso por resultado al tratamiento
a) Pacientes tratados por TB sensible a los medicamentos;
b) Pacientes tratados por TB resistente a medicamentos con tratamiento de segunda línea.
Los dos grupos son mutuamente excluyentes. Cualquier paciente que tiene TB resistente y es puesto en tratamiento de segunda línea es retirado de la cohorte de resultado de la TB sensible. Esto significa que el manejo del registro estándar de TB y el registro de tratamiento de TB con segunda línea necesita ser coordinado para garantizar la adecuada contabilidad de los resultados del tratamiento.
Resultados del tratamiento de pacientes con TB (excluye pacientes tratados por TB-RR o TB-MDR)
Todos los casos de TB bacteriológicamente confirmados y clínicamente diagnosticados deben ser asignados a un resultado de esta lista, excepto aquellos con TB-RR o TB-MDR, que se colocan en un esquema con medicamentos de segunda línea.
a) Curado: Paciente con TB pulmonar con bacteriología confirmada al inicio del tratamiento y que tiene baciloscopia o cultivo negativo en el último mes de tratamiento;
b) Tratamiento terminado: Paciente con TB que completó el tratamiento sin evidencia de fracaso, PERO sin constancia que muestre que la baciloscopia o el cultivo del último mes de tratamiento, ya sea porque las pruebas no se hicieron, o porque los resultados no estén disponibles;
c) Fracaso: Paciente con TB cuya baciloscopia o cultivo de esputo es positivo en el mes 4 o posterior durante el tratamiento;
d) Fallecido: Paciente con TB que muere por cualquier razón antes de comenzar o durante el curso del tratamiento;
e) Pérdida en el seguimiento: Paciente con TB que no inició tratamiento o interrumpió el tratamiento durante 1 mes o más;
f) No evaluado: Paciente con TB que no se le ha asignado el resultado de tratamiento. Incluye los casos “transferidos” a otra unidad de tratamiento y también los casos cuyo resultado del tratamiento se desconoce en la unidad que reporta;
g) Tratamiento exitoso: La suma de curados y tratamientos terminados.
Si se encuentran en cualquier momento pacientes que tienen una TB-RR o TB-MDR, deben comenzar con un esquema adecuado con medicamentos de segunda línea. Estos casos son excluidos de la cohorte principal de TB cuando se calculen los resultados del tratamiento (estos eran los antiguos fracasos) y se los incluye solo en el análisis de cohorte de tratamiento de TB con medicamentos de segunda línea.
Tabla No 1 Resultados de pacientes con TB-RR/MDR/XDR tratados con tratamiento de segunda línea
| Resultado | Definición |
| Curado | Tratamiento completo según lo recomendado por la política nacional sin evidencia de fracaso Y tres o más cultivos negativos consecutivos con intervalo de por lo menos 30 días entre ellos, después de la fase intensiva. |
| Tratamiento terminado | Tratamiento completo según lo recomendado por la política nacional sin evidencia de fracaso, PERO sin constancia de tres o más cultivos negativos consecutivos con al menos 30 días de intervalo después de la fase intensiva. |
| Fracaso al tratamiento | Tratamiento suspendido o necesidad de cambio permanente de esquema o por lo menos de dos fármacos antiTB debido a: · Falta de conversión al final de la fase intensiva a, o · Reversión bacteriológica en la fase de continuación después de conversión a negativo, o |
· Evidencia de resistencia adicional adquirida a las fluoroquinolonas o medicamentos inyectables de segunda línea; o,
· Reacciones adversas a medicamentos (RAM).
| Resultado | Definición |
| Fallecido | Un paciente que muere por cualquier razón durante el curso del tratamiento. |
| Pérdida en el seguimiento | Un paciente cuyo tratamiento fue interrumpido durante 2 meses consecutivos o más. |
| No evaluado | Un paciente al que no se le ha asignado ningún resultado del tratamiento. (Esto incluye los casos “transferidos a” otra unidad de tratamiento y cuyos resultados del tratamiento se desconocen). |
| Tratamiento exitoso | La suma de curados y tratamientos completos. |
Fuente: Adoptado de “Definitions and reporting framework for tuberculosis – 2013 (actualizado en diciembre de 2014)” Organización Mundial de la Salud.
Para el fracaso al tratamiento, la falta de conversión al final de la fase intensiva implica que el paciente no convierte dentro de la duración máxima de la fase intensiva aplicada por el programa.
Los términos “conversión” y “reversión” del cultivo tal como se utiliza aquí se definen como sigue:
Conversión (a negativo): la conversión negativa del cultivo se considera cuando dos cultivos consecutivos, tomados al menos con intervalo de 30 días, se encuentran negativos. En tal caso, la fecha de recolección de la muestra del primer cultivo negativo se usa como la fecha de conversión.
Reversión (a positivo): se considera que el cultivo revierte a positivo cuando, después de una conversión inicial, se encuentran dos cultivos consecutivos positivos, tomados al menos con intervalo de 30 días. Para el propósito de definir el fracaso al tratamiento, la reversión se considera solo cuando se produce en la fase de continuación.
DIRECTRICES Y RECOMENDACIONES DEL COMITÉ NACIONAL ASESOR PARA EL TRATAMIENTO DE LA ENFERMEDAD TUBERCULOSA ACTIVA.
El tratamiento del enfermo con tuberculosis debe hacerse de manera ambulatoria, la hospitalización se realiza solo en casos especiales según el criterio médico y/o la condición del paciente en relación con su enfermedad.
Previo al inicio del tratamiento, todo paciente debe ser evaluado por el médico quien diligenciará la tarjeta individual del paciente y la ficha de notificación del Sivigila en sus partes correspondientes, incluyendo el esquema de tratamiento. La administración del tratamiento debe ser supervisado (el paciente toma los medicamentos bajo estricta observación).
1. CONSIDERACIONES EN EL TRATAMIENTO
En pacientes nuevos que tengan baciloscopia positiva al final del segundo mes de tratamiento, se deberá solicitar cultivo y pruebas de sensibilidad a fármacos (PSF) y continuar con los medicamentos de primera fase (fase intensiva) hasta obtener los resultados de las PSF. Si el cultivo es negativo o positivo pero con susceptibilidad a los medicamentos, se pasa a segunda fase hasta completar un esquema total de 9 meses de tratamiento. Si la prueba de sensibilidad demuestra resistencia, el paciente debe ser evaluado por el especialista y se debe instaurar un esquema de acuerdo con los parámetros y lineamientos para el manejo de personas con Tuberculosis con farmacorresistencia. Si durante el seguimiento el paciente presenta baciloscopia o cultivo positivo en alguno de sus controles se deberá realizar PSF.
2. ESQUEMAS DE TRATAMIENTO
3.
a) ADULTOS:
Las siguientes son las dosis recomendadas de los medicamentos de primera línea utilizados para el tratamiento de la tuberculosis en adultos:
Tabla No 1. Medicamentos, dosis y esquemas para el tratamiento de tuberculosis sensible en adultos y niños con peso mayor o igual a 25 kg.
| Medicamento | Dosis diaria (mg/kg) Rango entre paréntesis | Dosis 3/semana (mg/kg) Rango entre paréntesis | Dosis máxima/día |
| Isoniazida (H) | 5 (4 a 6) | 10 (8 a 12) | Diaria: 300mg; 3/semanal 900mg |
| Rifampicina (R) | 10 (8 a 12) | 10 (8 a 12) | Diaria: 600mg; 3/semanal 600mg |
| Pirazinamida (Z) | 25 (20 a 30) | 35 (30 a 40) | |
| Etambutol (E) | 15 (15 a 20) | 30 (25 a 35) | |
Fuente: Treatment of tuberculosis Guidelines. Fourth edition. World Health Organization 2010.
Tabla No 2 Recomendaciones para el tratamiento de tuberculosis en adultos y niños con peso mayor a 30 kg, usando dosis fija combinada - DFC - de RHZE 150/75/400/275 y RH 150/150.
| Rango de peso en Kg | Número de tabletas | |
| Fase intensiva diaria, lunes a sábado (56 dosis) | Fase de continuación tres veces por semana (56 dosis) | |
| RHZE* 150/75/400/275 | RH 150/150 | |
| 30-39 | 2 | 2 |
| 40-54 | 3 | 3 |
| 55 Kg o más | 4 | 4 |
Fuente: Adaptado de Managing pharmaceuticals and commodities for tuberculosis: a guide for national tuberculosis programs. Arlington, VA, Management Sciences for Health, 2005.
Recuerde
-- En cada control verificar el peso del paciente y ajustar las dosis del medicamento acorde al peso.
-- En personas con pesos extremos verifique las dosis/peso Kg para evitar subdosificación o sobredosificación.
Tabla No 3 Recomendaciones para el tratamiento de tuberculosis en adultos con TB/VIH utilizando dosis fija combinada - DFC - de RHZE 150/75/400/275, RH 150/150 y RH 150/75
| Rango de peso en Kg | Número de tabletas | |
| Fase intensiva Diaria de lunes a sábado (56 dosis) | Fase de continuación Diaria de lunes a sábado, (196 dosis) | |
| RHZE 150/75/400/275 | RH 150/75 | |
| 30-39 | 2 | 2* |
| 40-54 | 3 | 3 |
| 55 o más | 4 | 4 |
Fuente: Adaptado de Managing pharmaceuticals and commodities for tuberculosis: a guide for national tuberculosis programs. Arlington, VA, Management Sciences for Health, 2005.
*Para los pacientes con peso entre 30-39 kg puede utilizarse la presentación RH 150/150 de manera diaria en la fase de continuación, ya que no supera las dosis diarias máximas permitidas de Isoniazida.
En caso de no contar con la presentación RH 150/75 se utilizará la presentación RH 150/150 trisemanal.
Consideraciones:
– En personas con tuberculosis e insuficiencia renal que se encuentran en terapia dialítica, se recomienda administrar la dosis del esquema estándar posterior a la diálisis.
– En las personas con tuberculosis e insuficiencia renal que no se encuentran en terapia dialítica, se recomienda ajustar las dosis de Etambutol de acuerdo a los resultados de las pruebas de función renal.
– Casos especiales de personas con tuberculosis y otras comorbilidades como insuficiencia hepática deberán ser evaluados con el especialista con dosificación individualizada.
b) NIÑOS:
Las siguientes son las dosis recomendadas de medicamentos antituberculosis para uso diario en el tratamiento de la tuberculosis en los niños (peso menor a 25kg):
| Medicamento | Dosis diaria (mg/kg) Rango entre paréntesis | Dosis máxima |
| Isoniazida (H) | 10 mg/kg (7 - 15 mg/kg) | 300 mg /día |
| Rifampicina (R) | 15 mg/kg (10 – 20 mg/kg) | 600 mg /día |
| Pirazinamida (Z) | 35 mg/kg (30 a 40 mg/kg) | |
| Etambutol (E) | 20 mg/kg (15 a 25 mg/kg) | |
Fuente: Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
Nota: Una vez que los niños alcancen un peso de 25 Kg, se utilizarán las dosis de medicamentos para adultos.
Tabla No 4. Directrices provisionales para el tratamiento de la tuberculosis en niños (con peso menor de 30 kg) usando la Dosis Fija Combinada (DFC) actualmente disponibles (RHZ 60/30/150) y las dosificaciones alcanzadas por peso:
| Rango de peso en Kg | Número de tabletas | |
| Fase intensiva diaria de lunes a sábado (56 dosis) | ||
| RHZ (60/30/150) | Etambutol (100 mg)* | |
| 4-6 | 1 | 1 |
| 7-10 | 2 | 2 |
| 11-14 | 3 | 2 |
| 15-19 | 4 | 3 |
| 20-24 | 5 | 4 |
| 25-29** | 5 | 5 |
Fuente: Adaptado de Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014. Anexo 5: Interim guidelines for treatment of TB in young children (less than 25 kg) using currently available FDCs (RHZ 60/30/150) and dosages achieved per weight.
* Esta presentación de Etambutol no se encuentra disponible en el país. Durante el año 2015 el Ministerio gestionará la adquisición de la misma. Mientras tanto se deberá calcular el número de tabletas a administrar de acuerdo al peso y la presentación disponible.
**El número de tabletas para los niños de 25-29 kg están calculadas con base en las dosis de adultos, pero administradas en presentaciones pediátricas. Esto siguiendo las recomendaciones del documento Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
Para los niños con 30 Kg o más utilice la tabla de adulto con las dosis y presentaciones de adultos.
Para la fase de continuación, se recomienda utilizar la siguiente tabla:
Tabla No 5 Fase de continuación
| Rango de peso en Kg | RH (60/30)* Esquema recomendado diario de lunes a sábado (112 dosis) | RH (150/150) Diario (112 dosis) |
| 4-6 | 1 | --- |
| 7-10 | 2 | --- |
| 11-14 | 3 | --- |
| 15-19 | 4 | --- |
| 20-24 | 5 | --- |
| 25-29** | --- | 2 |
Fuente: Adaptado de Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
* Esta presentación no se encuentra disponible en el país. Durante el año 2015 el Ministerio gestionará la adquisición de la misma.
**El número de tabletas administradas para los niños de 25-29 kg están calculadas con base en las dosis de adultos. Esto siguiendo las recomendaciones del documento Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
Recuerde:
-- Se debe pesar a los niños en cada consulta y ajustar el esquema de tratamiento de acuerdo al peso.
-- En casos excepcionales en que se ha descartado coinfección con VIH y no sea posible la administración diaria del medicamento, se puede considerar la administración trisemanal del tratamiento con la presentación RH 60/60 como lo indica la siguiente tabla:
Tabla No 6 Fase de continuación con la presentación RH 60/60
| Rango de peso en Kg. | RH (60/60) tres veces por semana (56 dosis) | RH (150/150) Diario (112 dosis) |
| 4-6 | 1 | --- |
| 7-11 | 2 | --- |
| 12-15 | 3 | --- |
| 16-19 | 4 | --- |
| 20-24 | 5 | --- |
| 25-29** | 5 | 2 |
Recomendaciones específicas:
– Debido a que Colombia presenta una prevalencia superior al 5% de VIH entre los casos con TB se recomienda que los niños con TB pulmonar o linfadenitis tuberculosa periférica sean tratados con un régimen de cuatro fármacos (HRZE) por 2 meses seguidos de un régimen de dos fármacos (HR) durante 4 meses en las dosificaciones determinadas[1].
– Los niños de 0-3 meses de edad con TB pulmonar o linfadenitis tuberculosa periférica presunta o confirmada, deben tratarse con prontitud con los regímenes de tratamiento descritos. El tratamiento puede requerir ajuste de dosis para mediar el efecto de la edad y la posible toxicidad en lactantes. La decisión de ajustar la dosis debe tomarse por un médico con experiencia en el manejo de la TB pediátrica[2].
– Los niños con sospecha o confirmación de meningitis tuberculosa o TB osteoarticular deben ser tratados con un régimen de cuatro fármacos (HRZE) por 2 meses, seguido de un régimen de dos fármacos (HR) durante 10 meses, la duración total del tratamiento es de 12 meses. Las dosis recomendadas para el tratamiento de la meningitis tuberculosa son iguales a las descritas para tuberculosis pulmonar[3].
– Se recomienda que los niños con tuberculosis e infección por VIH confirmada no sean tratados con regímenes intermitentes (3 veces por semana) en la fase de continuación[4]. Sin embargo, su aplicación está sujeta a las presentaciones de medicamentos disponibles en el país. La duración de la fase de continuación será de 98 dosis en esquemas trisemanales y 196 dosis en esquemas diarios para este tipo de casos.
– En todos los casos se deberá hacer un seguimiento estricto a las reacciones adversas a fármacos antituberculosis.
BIBLIOGRAFÍA
1. World Health Organization [homepage en Internet]. 2013. [consultado 23 de septiembre de 2013]. Tuberculosis country profiles. Disponible en: http://www.who.int/tb/country/data/profiles/en/.
2. World Health Organization [homepage en Internet]. 2013. [consultado 23 de septiembre de 2013]. Childhood tuberculosis. Disponible en: http://www.who.int/tb/challenges/children/en/.
3. Departamento Administrativo Nacional de Estadística DANE [homepage en Internet]. 2013. [consultado 23 de septiembre de 2013]. Estadísticas Vitales. Disponible en: http://www.dane.gov.co/index.php/poblacion-y-demografia/nacimientos-y-defunciones.
4. Recommendation 11. Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
5. Recommendation 14. Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
6. Recommendation 26. Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
DIRECTRICES Y RECOMENDACIONES DEL COMITÉ NACIONAL ASESOR PARA EL DIAGNÓSTICO Y TRATAMIENTO DE LA INFECCIÓN TUBERCULOSA LATENTE.
1. GRUPOS PRIORITARIOS PARA LA BÚSQUEDA DE INFECCIÓN TUBERCULOSA LATENTE:
Teniendo en cuenta las recomendaciones de la OMS en su documento: “Directrices sobre la atención de la infección tuberculosa latente” publicado en noviembre de 2014[5], los grupos prioritarios para búsqueda de la infección tuberculosa latente en Colombia serán:
-- Personas que viven con VIH;
-- Niños en contacto con enfermos de TB pulmonar;
-- Personas que vayan a comenzar tratamientos con terapia biológica para enfermedades autoinmunes;
-- Personas con insuficiencia renal crónica sometidas a diálisis;
-- Personas que se preparan para recibir trasplantes de órganos o hemáticos;
-- Personas con silicosis.
Trabajadores de la salud y población privada de la libertad serán considerados en directrices específicas posteriores.
Durante el año 2015 la prioridad continuarán siendo las personas que viven con VIH y los niños menores de 5 años contacto de personas con TB activa; sin embargo, a medida que se incrementen las existencias de Isoniazida, se entregará desde el Ministerio de Salud y Protección Social la profilaxis para el tratamiento de la infección tuberculosa latente en los otros grupos mencionados, mientras tanto, la profilaxis estará a cargo del aseguramiento del usuario.
2. PROCESO DIAGNÓSTICO DE LA INFECCIÓN TUBERCULOSA LATENTE:
El primer paso en el proceso diagnóstico de la TB latente es descartar la tuberculosis activa en los grupos priorizados, preguntando a las personas si presentan síntomas de TB tales como: tos, hemoptisis, fiebre, sudores nocturnos, pérdida de peso o pobre ganancia de peso (niños), disnea y fatiga[6].
En caso de presentar síntomas de TB, se deben realizar los estudios para descartar tuberculosis activa.
En caso de no presentar síntomas de TB se procederá a solicitar la PPD, la cual se considerará positiva en estos grupos priorizados cuando se presente una induración de 5 mm o más.
Una prueba de tuberculina positiva por sí sola no distingue entre la infección tuberculosa latente y la enfermedad tuberculosa activa. En los pacientes con Sida, o en pacientes severamente desnutridos o con tuberculosis miliar, la prueba de tuberculina puede incluso ser negativa aunque tengan la enfermedad tuberculosa activa[7].
Ante la sospecha de un falso negativo, se recomienda repetir la prueba una semana después de la primera para evaluar el efecto booster[8]. Si este segundo resultado es positivo se procederá a diferenciar entre tuberculosis activa y tuberculosis latente. Si este segundo resultado es negativo, se considera que la persona no ha estado expuesta a la infección por tuberculosis. (Para mayor información sobre la PPD por favor remítase a la Guía para la aplicación y lectura de la prueba de tuberculina publicada por el Ministerio de Salud y Protección Social y la Organización Panamericana de la Salud, 2012).
La PPD debe realizarse utilizando el método de Mantoux. El método de múltiples punciones no se debe utilizar, dado que los resultados de la prueba no son confiables debido a que la cantidad de tuberculina inyectada por vía intradérmica no se puede controlar.
Si la PPD es positiva se recomienda realizar una radiografía de tórax y, de acuerdo a los resultados, iniciar el tratamiento de TB latente. (Ver a continuación algoritmo diagnóstico para TB latente).
ALGORITMO DIAGNÓSTICO PARA TB LATENTE EN COLOMBIA
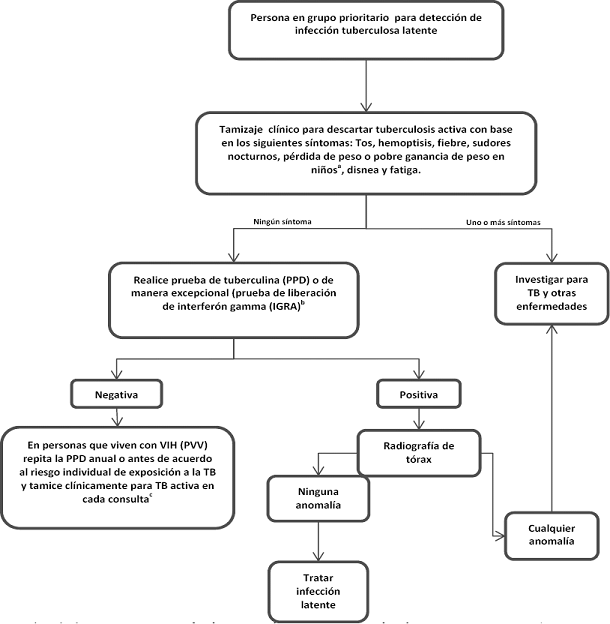
Fuente: Adaptado de OMS “Directrices sobre la atención de la infección tuberculosa latente” 2015 y WHO HIV/AIDS Programme, “Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection, Recommendations for a public health approach”, June 2013.
Notas al Algoritmo:
a) Pobre ganancia de peso en niños se define como:
-- Reportada pérdida de peso o muy bajo peso (peso para la edad menor que -3Z);
-- Bajo peso (peso para la edad menor que -2Z).
-- Pérdida de peso confirmada (>5%) desde la última visita.
-- Curva de crecimiento estancada[9];
b) Aunque la evidencia demuestra que se pueden utilizar tanto las pruebas de liberación de interferón gamma (IGRA) como la prueba cutánea de la tuberculina (PPD) para la identificación de las personas con infección tuberculosa latente, en Colombia la prueba de elección es la PPD;
c) El tamizaje clínico de rutina en personas que viven con VIH incluye la evaluación de: fiebre, tos, pérdida de peso y diaforesis nocturna de cualquier duración en cada consulta. La ausencia de estos cuatro síntomas tiene un valor predictivo negativo de tuberculosis del 97,7%[10]. En caso de presentarse uno o más de estos síntomas, se debe investigar para tuberculosis activa.
3. ESQUEMAS DE TRATAMIENTO DE LA INFECCIÓN TUBERCULOSA LATENTE
La pauta de elección para el tratamiento de la infección tuberculosa latente en Colombia es Isoniazida:
En adultos 5 mg/kg/día máximo 300 mg día por 9 meses[11]
En niños 10 mg/kg/día máximo 300 mg día por 9 meses[12]
Las personas que viven con VIH, contacto de una persona con tuberculosis activa, deben recibir profilaxis con Isoniazida, independiente del resultado de la PPD, luego de descartar TB activa. En niños que viven con VIH menores de 12 meses, se administrará profilaxis con Isoniazida solo si tienen contacto con un caso confirmado de TB y no tienen tuberculosis activa, luego de las investigaciones de rutina[13].
4. SEGUIMIENTO AL TRATAMIENTO:
Con el fin de evaluar las condiciones clínicas de los pacientes a los cuales se les inicia el tratamiento de la infección tuberculosa latente, se recomienda realizar controles médicos mensuales donde se determine la adherencia al tratamiento y la identificación temprana de reacciones adversas, y se entregue el medicamento con esta misma periodicidad para tratamiento autoadministrado.
Como parte del proceso de seguimiento, el Ministerio ha estandarizado una ficha de control para el tratamiento de la infección tuberculosa latente, la cual deberá ser diligenciada por el personal a cargo de la atención y seguimiento de los pacientes.
La terapia preventiva con Isoniazida no aumenta el riesgo de resistencia a la Isoniazida si se ha descartado tuberculosis activa. Por lo tanto, esta consideración no debe constituirse en una barrera de acceso a la profilaxis[14, 15, 16].
Bibliografía
1. World Health Organization [homepage en Internet]. 2013. [consultado 23 de septiembre de 2013]. Tuberculosis country profiles. Disponible en: http://www.who.int/tb/country/data/profiles/en/.
2. World Health Organization [homepage en Internet]. 2013. [consultado 23 de septiembre de 2013]. Childhood tuberculosis. Disponible en: http://www.who.int/tb/challenges/children/en/.
3. Departamento Administrativo Nacional de Estadística DANE [homepage en Internet]. 2013. [consultado 23 de septiembre de 2013]. Estadísticas Vitales. Disponible en: http://www.dane.gov.co/index.php/poblacion-y-demografia/nacimientos-y-defunciones.
4. Recommendation 11. Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
5. Recommendation 14. Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
6. Recommendation 26. Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
ACTIVIDADES COLABORATIVAS TB/VIH.
ACTIVIDADES COLABORATIVAS TB/VIH
El Ministerio de Salud y Protección Social hace un llamado a fortalecer la implementación de las actividades colaborativas TB/VIH, bajo las siguientes directrices:
1. Coordinación de las actividades colaborativas TB/VIH: Todas las entidades territoriales deberán contar con una mesa colaborativa TB/VIH o una instancia de coordinación de las actividades colaborativas en las que deben participar los referentes de TB, SSR/VIH y vigilancia epidemiológica, las EAPB, ESE, IPS de atención integral del VIH y representantes de la sociedad civil. En el marco de estas instancias se deberá planificar conjuntamente las actividades, a fin de optimizar los recursos para la implementación y seguimiento del Plan Nacional de Actividades Colaborativas TB/VIH 2014-2017.
2. Búsqueda activa de casos de TB en Personas que viven con VIH (PVV): En las PVV el riesgo anual de reactivación de infección latente por M. tuberculosis es del 5-10% (1) y sus manifestaciones son ampliamente variables de acuerdo al nivel de inmunosupresión de la PVV, por ello no aplica la definición tradicional de sintomático respiratorio, y se recomienda el tamizaje clínico para TB en cada consulta basado en los siguientes síntomas: Tos, fiebre, pérdida de peso y sudoración nocturna de cualquier duración (2). La ausencia de estos cuatro síntomas tiene un valor predictivo negativo de tuberculosis del 97,7% (3). En caso de presentarse uno o más de estos síntomas se debe investigar para tuberculosis activa.
3. Diagnóstico de TB en PVV: Toda vez que esté disponible en la entidad territorial o a través de procesos de remisión de muestras, de acuerdo a la contratación de la EPS responsable de la atención de la PVV, se deberá ofrecer a las PVV pruebas moleculares para el diagnóstico oportuno de la TB, teniendo en cuenta su mayor sensibilidad en este grupo de pacientes; esto sin detrimento de las pruebas diagnósticas convencionales (baciloscopia, Rx de Tórax, cultivo, pruebas de sensibilidad, entre otras) (4). En algunos casos será necesario iniciar el tratamiento antituberculosis basado en criterios clínicos, a pesar de pruebas diagnósticas negativas, teniendo en cuenta la alta sospecha clínica y el alto riesgo de mortalidad en estos pacientes (2).
4. Tratamiento de la TB activa en PVV: En las PVV coinfectadas con TB se aplicarán los esquemas de tratamiento antituberculosis indicados en la presente circular, siguiendo los principios de la estrategia TAES (Tratamiento Administrado Estrictamente Supervisado), y el proceso de seguimiento que se implementa con las personas sin VIH.
5. Diagnóstico y tratamiento de la infección tuberculosa latente en PVV: Se aplicará el algoritmo diagnóstico y esquemas recomendados en la presente circular, en el componente de diagnóstico y tratamiento de la infección tuberculosa latente.
6. Control de infecciones: Todas las instituciones que ofrecen atención a personas que viven con VIH o atienden personas con tuberculosis deberán realizar seguimiento a la implementación de su plan institucional de control de infecciones y la aplicación de planes de mejora a los mismos, a través de su comité de vigilancia en salud pública.
7. Diagnóstico de infección por VIH en pacientes con TB: El diagnóstico del VIH en personas con tuberculosis se realiza, tanto para niños como para adolescentes y adultos, de igual manera que en la población general, de acuerdo a los algoritmos diagnósticos establecidos en las Guías de práctica clínica vigentes. Es fundamental la asesoría y oferta de la prueba voluntaria de VIH a toda persona con diagnóstico de TB, preferiblemente, en la misma institución donde el paciente está siendo atendido para la tuberculosis y utilizando pruebas rápidas de VIH como prueba presuntiva.
El resultado de la prueba presuntiva de VIH y otros resultados obtenidos en el marco de la implementación del algoritmo diagnóstico debe(n) ser entregado(s) a la persona con tuberculosis en el marco de una asesoría postest ofrecida por un profesional de la medicina u otra persona del equipo de salud debidamente entrenada en asesoría para VIH, según la normativa vigente (5).
8. Prevención del VIH en personas con tuberculosis: Toda persona con tuberculosis debe recibir por lo menos una vez por mes educación en la prevención del VIH y condones para su protección de las ITS/VIH durante su tratamiento para la tuberculosis (6).
9. Profilaxis con Trimetoprim / Sulfametoxazol (Cotrimoxazol) en personas con coinfección TB/VIH: Toda persona con TB/VIH deberá recibir profilaxis para neumonía por Pneumocystis jiroveci con trimetoprim-sulfametoxazol, 160/800 mg diarios, por lo menos hasta que se cuente con el resultado del conteo de CD4 y el médico experto en VIH defina su continuación o no.
10. Tratamiento del VIH en personas con Tuberculosis: En la persona que vive con VIH que aún no ha iniciado tratamiento antirretroviral el inicio del tratamiento antituberculoso es siempre la prioridad, seguido del inicio de la terapia antirretroviral tan pronto como se ha tolerado el tratamiento antituberculoso, de acuerdo a los tiempos que se describen a continuación:
-- Si la persona con TB/VIH se encuentra severamente inmunosuprimida (CD4 menor de 50 células / mm3), se debe iniciar tratamiento antirretroviral en las primeras 2 semanas después del inicio del tratamiento antituberculoso (7,8).
-- Si la persona con TB/VIH tiene un CD4 mayor o igual a 50 cells/mm3 y presenta enfermedad clínica severa (baja funcionalidad [Karnofsky score], bajo IMC [BMI], baja hemoglobina, baja albumina, disfunción de órganos o enfermedad extensa), se recomienda el inicio del tratamiento antirretroviral dentro de 2 a 4 semanas después de iniciar el tratamiento antituberculoso (8).
-- En todos los pacientes con coinfección TB/VIH el tratamiento antirretroviral debe haberse iniciado en las primeras 8 semanas después de iniciar el tratamiento antituberculoso, incluyendo niños, personas con TB MDR o XDR y mujeres embarazadas coinfectadas con VIH (7,8).
A pesar de que el inicio temprano de la terapia antirretroviral incrementa también la posibilidad de desarrollar el síndrome inflamatorio de reconstitución inmune (SIRI o IRIS en inglés), este riesgo no supera el riesgo de mortalidad cuando se retrasa el inicio de la terapia antirretroviral.
El esquema de tratamiento antirretroviral más adecuado deberá ser seleccionado por un médico experto en VIH, teniendo presente que la Rifampicina es el mejor medicamento antituberculoso con el que se cuenta, y por tanto, se debe preservar en el esquema de tratamiento antituberculoso tanto como sea posible, ajustando el tratamiento antirretroviral de acuerdo a las posibles interacciones medicamentosas descritas en la literatura.
REFERENCIAS BIBLIOGRÁFICAS
1. McShane H, Co-infection with HIV and TB: double trouble. International Journal of STD & AIDS 2005; 16: 95–101. Citado en: Gutierrez R, Gotuzzo E, Co- infección VIH y Tuberculosis. Uso de antirretrovirales. Instituto de Medicina Tropical “AvH”.Facultad de Medicina. Universidad Peruana Cayetano Heredia. TELEMEDICINA. [consultado 12 de noviembre de 2014]. Disponible en: http://www.upch.edu.pe/tropicales/telemedicinatarga/REVISION%20DE%20TEMAS/VIH-TB%20modificado.pdf
2. Organización Panamericana de la Salud. Coinfección TB/VIH: Guía Clínica. Versión actualizada – 2010. Washington D.C.: OPS; 2010.
3. Getahun H, Kittikraisak W, Heilig C, Corbett E, Ayles H, Cain K, et al. Development of a Standardized Screening Rule for Tuberculosis in People Living with HIV in Resource-Constrained Settings: Individual Participant Data Meta-analysis of Observational Studies. PLoS Med [serie en internet]. 2011 [citado 9 diciembre de 2013]; 8(1): [aprox. 23 p.]. Disponible en: http://www.plosmedicine.org/article/info%3Adoi%2F10.1371%2Fjournal.pmed.1000391
4. World Health Organization. Automated real-time nucleic acid amplification technology for rapid and simultaneous detection of tuberculosis and rifampicin resistance: Xpert MTB/RIF system for the diagnosis of pulmonary and extrapulmonary TB in adults and children: policy update. 2013. Pre-publication copy.
5. Ministerio de Salud y Protección Social. Pautas para la realización de Asesoría y Prueba Voluntaria para VIH (APV) con enfoque diferencial y de vulnerabilidad. 2012. Disponible en: http://www.minsalud.gov.co/proteccionsocial/Paginas/Observatorio_documentos_pautas_asesoria_prueba_voluntaria.aspx
6. Organización Mundial de la Salud. Política de la OMS sobre actividades de colaboración TB/VIH – Guías para programas nacionales y otros interesados directos. 2012 [consultado marzo de 2013]. Disponible en http://apps.who.int/iris/bitstream/10665/44838/1/9789243503004_spa.pdf?ua=1&ua=1
7. World Health Organization. Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection, Recommendations for a public health approach, June 2013. London: WHO; 2013.
8. Department of Health and Human Services. Guidelines for the Use of Antirretroviral Agents in HIV-1 infected Adults and Adolescents. AIDSinfo; 2013. [consultado 3 de octubre de 2013]. Disponible en: http://aidsinfo.nih.gov/guidelinesWorld Health Organization. Treatment of tuberculosis guidelines. 4a. ed. 2010. [consultado octubre de 2013]. Disponible en http://www.who.int/tb/publications/tb_treatmentguidelines/en/
* * *
1. Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
2. Recommendation 14. Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
3. Recommendation 14. Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 2014.
4. Recommendation 26. Guidance for national tuberculosis programmes on the management of tuberculosis in children 2nd ed. World Health Organization, 201.
5. Organización Mundial de la Salud. Directrices sobre la atención de la infección tuberculosa latente. 2015. [consultado 5 de noviembre de 2014]. Disponible en: http://apps.who.int/iris/bitstream/10665/137336/1/9789243548906_spa.pdf?ua=1
6. Organización Mundial de la Salud. Directrices sobre la atención de la infección tuberculosa latente. 2015. [consultado 5 de noviembre de 2014]. Disponible en: http://apps.who.int/iris/bitstream/10665/137336/1/9789243548906_spa.pdf?ua=1
7. Organización Panamericana de la Salud. Coinfección TB/VIH: Guía Clínica. Versión actualizada – 2010. Washington D.C.: OPS; 2010.
8. Caminero JA, Farga V. Tuberculosis. 3ª edición. 2011. Editorial Mediterráneo.
9. WHO HIV/AIDS Programme. Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection, Recommendations for a public health approach. June 2013.
10. Getahun H, Kittikraisak W, Heilig C, Corbett E, Ayles H, Cain K, et al. Development of a Standardized Screening Rule for Tuberculosis in People Living with HIV in Resource-Constrained Settings: Individual Participant Data Meta-analysis of Observational Studies. PLoS Med [serie en internet]. 2011 [citado 9 diciembre de 2013]; 8(1): [aprox. 23 p]. Disponible en: http://www.plosmedicine.org/article/info%3Adoi%2F10.1371%2Fjournal.pmed.1000391
11. Organización Mundial de la Salud. Directrices sobre la atención de la infección tuberculosa latente. 2015. [consultado 5 de noviembre de 2014]. Disponible en: http://apps.who.int/iris/bitstream/10665/137336/1/9789243548906_spa.pdf?ua=1
12. Organización Mundial de la Salud. Directrices sobre la atención de la infección tuberculosa latente. 2015. [consultado 5 de noviembre de 2014]. Disponible en: http://apps.who.int/iris/bitstream/10665/137336/1/9789243548906_spa.pdf?ua=1
13. WHO HIV/AIDS Programme. Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection, Recommendations for a public health approach. June 2013.
14. Organización Mundial de la Salud. Directrices sobre la atención de la infección tuberculosa latente. 2015. [consultado 5 de noviembre de 2014]. Disponible en: http://apps.who.int/iris/bitstream/10665/137336/1/9789243548906_spa.pdf?ua=1
15. WHO HIV/AIDS Programme. Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection, Recommendations for a public health approach. June 2013.
16. World Health Organization. Guidelines for intensified tuberculosis case-finding and isoniazid preventive therapy for people living with HIV in resource-constrained settings. Italy: WHO; 2011.
Las notas de vigencia, concordancias, notas del editor, forma de presentación y disposición de la compilación están protegidas por las normas sobre derecho de autor. En relación con estos valores jurídicos agregados, se encuentra prohibido por la normativa vigente su aprovechamiento en publicaciones similares y con fines comerciales, incluidas -pero no únicamente- la copia, adaptación, transformación, reproducción, utilización y divulgación masiva, así como todo otro uso prohibido expresamente por la normativa sobre derechos de autor, que sea contrario a la normativa sobre promoción de la competencia o que requiera autorización expresa y escrita de los autores y/o de los titulares de los derechos de autor. En caso de duda o solicitud de autorización puede comunicarse al teléfono 617-0729 en Bogotá, extensión 101. El ingreso a la página supone la aceptación sobre las normas de uso de la información aquí contenida.