



CIRCULAR 13 DE 2022
(julio 25)
Diario Oficial No. 52.107 de 26 de julio de 2022
<Surte efecto a partir del 26 de septiembre de 2022>
COMISIÓN NACIONAL DE PRECIOS DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS
<NOTA DE VIGENCIA: Circular derogada por la Circular 19 de 2024>
Por la cual se establece el listado de los medicamentos sujetos al régimen de control directo de precios, se fija el precio máximo de venta y el precio por unidad de regulación de Medicamentos Vitales No Disponibles y se dictan otras disposiciones.
LA COMISIÓN NACIONAL DE PRECIOS DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS,
en uso de sus facultades legales, en especial las conferidas por los artículos 245 de la Ley 100 de 1993, 87 de la Ley 1438 de 2011, 72 de la Ley 1753 de 2015 y 1o del Decreto 705 de 2016, y
CONSIDERANDO:
Que el artículo 60 de la Ley 81 de 1988 contempla las modalidades bajo las cuales se basa el ejercicio de la política de precios de diversos productos, entre los cuales se incluyen los medicamentos y dispositivos médicos, estableciendo los regímenes de control directo, libertad regulada y libertad vigilada.
Que el artículo 90 de la Ley 1438 de 2011, estableció que el Gobierno nacional de Colombia, en aras de garantizar la competencia efectiva para la producción, venta, comercialización y distribución de medicamentos y dispositivos médicos, podrá adelantar las gestiones necesarias para que la población disponga de estos productos con buena calidad y a precios accesibles.
Que la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos (CNPMDM), en adelante la Comisión, en uso de las facultades legales otorgadas y conforme a la delegación del Gobierno nacional, expidió la Circular 03 de 2013, mediante la cual se estableció la metodología para la aplicación del régimen de control directo de precios para los medicamentos que se comercialicen en el territorio nacional.
Que, a través de la Circular 7 de 2013, se incorporaron unos medicamentos al régimen de control directo, fijó su precio máximo de venta y en su artículo 1o, indicó: Subconjunto de medicamentos de mayor participación. Para los mercados relevantes con más de tres concurrentes e IHHx superior a 2.500 de que trata el artículo 19 numeral b) de la Circular 03 de 2013, se considera que los medicamentos de mayor participación corresponden a todos aquellos medicamentos con participación igual o superior al 10% del mercado relevante.
Que los medicamentos que fueron sometidos al proceso de referenciación internacional de precios en el segundo semestre del año 2021 se encuentran divididos en dos categorías a saber: i) Presentaciones comerciales de medicamentos que se incluyen por primera vez al régimen de control directo de precios, y ii) Medicamentos Vitales No Disponibles (MVND).
Que los mercados relevantes priorizados para el proceso de referenciación internacional de precios de medicamentos fueron seleccionados indistintamente del canal de comercialización, tomando en cuenta el nivel de venta de los mismos y/o su impacto en el recobro/cobro, con el cumplimiento del criterio de concentración de mercado con base en el cálculo del IHH o menos de tres oferentes, tal y como está establecido en la metodología para la aplicación del régimen de control directo de precios de medicamentos.
Que la Comisión expidió la Circular 12 de 2021, y a través de ella estableció el listado de los medicamentos sujetos al régimen de control directo de precios, fijó el precio máximo de venta y el precio por unidad de regulación de Medicamentos Vitales No Disponibles, de acuerdo con el IPC, con fundamento en la metodología prevista en la Circular 03 de 2013.
Que la Comisión tiene la facultad legal de incluir cualquier medicamento al régimen de control directo de precios, mediante la identificación de especulación de precios por parte de los laboratorios sobre algunos medicamentos y de igual forma identificados por medio de los reportes realizados en el Sistema de Información de Precios de Medicamentos (SISMED) durante el período de referencia.
Que la Comisión, realiza el cálculo del factor de ajuste del punto ex fábrica al punto mayorista con base en los márgenes contemplados por cada país de referencia cuyo resultado para la presente Circular es de 7,08% teniendo en cuenta los países de referencia donde se encontró información de precios.
Que, en aplicación del literal a) del artículo 21 de la Circular 03 de 2013, los MVND que serán objeto de regulación, a través de este acto, se seleccionaron, con base en la información de recobros/cobros suministrada por la Administradora de los Recursos del Sistema General de Seguridad Social en Salud - ADRES.
Que, para las presentaciones comerciales de medicamentos que no registraron reportes a nivel de ventas del productor o importador en el Sistema de Información de Precios de Medicamentos (SISMED) durante el período de referencia del 1 de octubre de 2020 al 30 de septiembre de 2021, se realizó una reconstrucción lineal del precio de la presentación comercial a partir del precio de los otros consecutivos del mismo expediente de registro sanitario que sí reportaron ventas en dichos niveles.
Que los Códigos Únicos de Medicamentos - CUM y los mercados relevantes contenidos en la Circular 12 de 2021, serán actualizados conforme a la variación del Índice de Precios al Consumidor - IPC de octubre a diciembre de 2021 (1.24%) y para los mercados relevantes contenidos en la Circular 10 de 2020 modificada por la 11 del 2020 corresponderá al incremento del IPC anual para 2021 (5,62%).
Que, con la entrada en vigor de la Resolución 2292 de 2021, se determinó la financiación con recursos de la Unidad de Pago por Capitación (UPC) para 912 grupos relevantes, pasando del 60.8% al 87.35% aproximadamente del total de los Códigos Únicos de Medicamentos - CUMS autorizados en el país y al 89,14% al incluir las formas farmacéuticas de la estrategia de Análisis de Impacto Presupuestal (AIP), razón por la cual los precios de los medicamentos financiados con estos recursos, deberán atender a lo regulado en este acto.
Que se realizó la apertura del mercado relevante ID 924 Fosfomicina por diferencias farmacocinéticas, debido a los valores de absorción, distribución y eliminación, además de que se ven diferencias en la indicación y dosificación de fosfomicina, se procede a separar el MR por Fosfomicina Trometamol y Fosfomicina Cálcica.
Que serán modificados los Precios Máximos de Venta establecidos para el mercado relevante ID MR 98 correspondiente al principio activo Insulina Lispro con forma farmacéutica líquido-sólido inyectable para los CUM 224030-1, 224030-2, 224030-3, 224030-4, 224030-5 y 224030-6, teniendo en cuenta que la presentación comercial de los mismos incluida en la Circular 12 de 2021 es diferente a la reportada en el registro sanitario expedido por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA). De igual manera, será modificado el Precio Máximo de Venta del mercado relevante ID MR 703 correspondiente al principio activo estrógenos conjugados para el CUM 19993161-2, puesto que la descripción comercial de este producto fue modificada por el INVIMA.
Que la Comisión evidenció que los mercados relevantes ID MR 112 (CUM 19928405-2) y ID MR 116 (CUM 19953204-7) correspondiente a los principios activos Octreotido - Líquido/Sólido - Inyectable y Pregabalina - Sólido - Oral, respectivamente serán eliminados por pertenecer a muestras médicas según lo reportado en el registro sanitario.
Que la Comisión evidenció que existía diferencia en el precio por unidad de regulación para el ID MR 782 correspondiente al principio activo Progesterona Semisólido - Vaginal, entre los anexos publicados en la página Web y lo publicado en la Circular 10 de 2020 actualizada por la Circular 12 de 2021, por lo tanto, se procede a actualizar el precio.
Que la Comisión en sesión del 21 de junio de 2022, decidió que era procedente efectuar la actualización en un solo cuerpo normativo, de las disposiciones relacionadas con el listado de los medicamentos sujetos al régimen de control directo de precios, fijar su precio máximo de venta, actualizar el precio de algunos medicamentos y establecer el precio por unidad de regulación de Medicamentos Vitales No Disponibles.
Que los precios máximos de venta fijados por la Comisión deben ser aplicados a nivel mayorista sin distinción de canales, siendo extensible sus efectos tanto a las entidades del Sistema General de Seguridad Social en Salud como a los regímenes Especiales y de Excepción.
Que la Secretaría Técnica de la Comisión envió en el año 2013 a la Superintendencia de Industria y Comercio-SIC, la Circular 03 de la misma anualidad que adopta la metodología general de referenciación internacional de precios para que se emitiera concepto de abogacía de la competencia, en el marco de lo dispuesto en artículo 7o de la Ley 1340 de 2009 y el Decreto 1074 de 2015, para lo cual esa Superintendencia con radicado SIC e13-117101-3-0 del 17 de mayo de 2013, conceptuó que “(…) las medidas contenidas en el proyecto de Circular no tienden a generar un efecto anticompetitivo respecto de los precios máximos para la comercialización de medicamentos en el país (…)”.
Que en el marco de la expedición de la Circular 07 de 2018, se consultó a la SIC sobre la necesidad de que dicho acto hubiera surtido el procedimiento de abogacía de la competencia, y en respuesta a esta consulta, la SIC, con radicado 18-281397-1-0 del 8 de noviembre de 2018, conceptuó que “(…) la Superintendencia de Industria y Comercio considera, frente a la solicitud concreta, que la Circular 07 de 2018 no tenía necesidad de surtir el trámite de abogacía de la competencia. Esta conclusión se desprende del hecho de que la Circular 07 de 2018 corresponde a una aplicación de la metodología establecida en la Circular 03 de 2013 (…)”.
Que considerando que lo dispuesto en la presente Circular atiende a la aplicación de la metodología establecida en la Circular 03 de 2013 sometida al trámite de abogacía de la competencia, se establece que resulta extensivo el concepto dado por la SIC en su momento y que fue referenciado.
Que en aplicación a la metodología de la Circular 03 de 2013, los mercados relevantes priorizados fueron sometidos a consulta pública a través de la página web del Ministerio de Salud y Protección Social, desde el 15 de septiembre de 2021 hasta el 8 de octubre de 2021, junto con los anexos que contienen todos los insumos e información así: i) Listado de mercados relevantes; ii) Estandarización de la base de datos de medicamentos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA); iii) Cálculo del índice Herfindahl Hirschman -IHH; iv) Medicamentos Vitales No Disponibles (MVND); y v) Formas farmacéuticas de los medicamentos sometidos al proceso de referenciación internacional de precios en el segundo semestre del año 2021.
Que el proyecto de la presente circular y su articulado completo fue sometido a consulta pública entre el 31 de diciembre de 2021 y el 10 de febrero de 2022, recibiendo comentarios de la ciudadanía que se analizaron y constituyen el fundamento de algunas de las decisiones adoptadas en la presente Circular.
En mérito de lo expuesto,
RESUELVE:
ARTÍCULO 1o. OBJETO. <Circular derogada por la Circular 19 de 2024> La presente Circular tiene por objeto establecer el listado de los medicamentos sujetos al régimen de control directo de precios, fijar el precio máximo de venta y el precio por unidad de regulación de Medicamentos Vitales No Disponibles.
ARTÍCULO 2o. ÁMBITO DE APLICACIÓN. <Circular derogada por la Circular 19 de 2024> La presente Circular aplica a:
2.1 Fabricantes, importadores, comercializadores y titulares de registro sanitario de medicamentos.
2.2. Prestadores de servicios de salud en todos los regímenes, incluyendo los regímenes Especiales y de Excepción.
ARTÍCULO 3o. INCORPORACIÓN DE MEDICAMENTOS A CONTROL DIRECTO. <Circular derogada por la Circular 19 de 2024> Incorpórense al régimen de control directo de precios en el nivel mayorista, los medicamentos que se relacionan a continuación:
<Nota: Cuadro no Incluido>.
PARÁGRAFO. El Precio Máximo de Venta de los medicamentos relacionados en el presente artículo, contempla los factores de ajuste que corresponden al promedio observado en los países de referencia entre el punto ex fábrica y el punto mayorista, estableciéndose como resultado el 7,08%.
ARTÍCULO 4o. PRECIO MÁXIMO DE VENTA DE MEDICAMENTOS ANTERIORMENTE REGULADOS. <Circular derogada por la Circular 19 de 2024> Fijese el Precio Máximo de Venta de los medicamentos regulados en anteriores circulares por esta Comisión, así:
<Consultar tabla directamente en el siguiente enlace:
http://168.61.69.177/documentospdf/PDF/C_CNPMD_0013_2022-ANEXO.pdf
PARÁGRAFO. El Precio Máximo de Venta del mercado relevante correspondiente al medicamento toxina botulínica solo aplicará para su uso terapéutico. Cualquier uso de este medicamento en las transacciones institucionales se entenderá como terapéutico y no podrá exceder el precio regulado. En las transacciones comerciales, el precio regulado aplicará solo para el uso terapéutico.
ARTÍCULO 5o. PRECIO POR UNIDAD DE REGULACIÓN DE MERCADOS RELEVANTES SOMETIDOS A LA METODOLOGÍA DE LA CIRCULAR 03 DE 2013. <Circular derogada por la Circular 19 de 2024> El precio por unidad de regulación para todos los mercados relevantes o subconjuntos de estos, que a la fecha han sido sometidos a la metodología de la Circular 03 de 2013, se establece a continuación. Estos constituyen un Precio Máximo de Venta para las operaciones realizadas en las transacciones institucionales.
<Consultar tabla directamente en el siguiente enlace:
http://168.61.69.177/documentospdf/PDF/C_CNPMD_0013_2022-ANEXO.pdf
PARÁGRAFO 1o. Los mercados relevantes listados en este artículo y que a su vez se encuentren incluidos en el artículo 8o de la presente Circular, deberán tener en cuenta lo establecido allí, en lo referente al monitoreo de precios que hace la Comisión en el momento de realizar operaciones en las transacciones institucionales.
PARÁGRAFO 2o. Los precios de presentaciones comerciales no mencionadas en los artículos 3 y 4 de la presente Circular, al igual que las nuevas presentaciones comerciales de medicamentos que conforman mercados relevantes aquí regulados, deberán acogerse a lo previsto en el artículo 5o del presente acto administrativo.
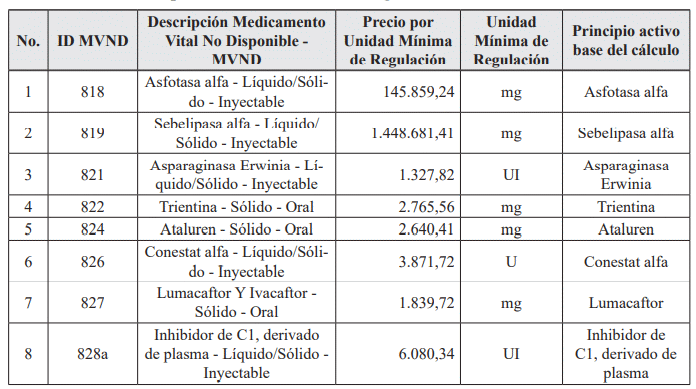
ARTÍCULO 6o. PRECIO POR UNIDAD DE REGULACIÓN DE MEDICAMENTOS VITALES NO DISPONIBLES. <Circular derogada por la Circular 19 de 2024> El Precio Máximo de Venta por unidad de regulación de los siguientes Medicamentos Vitales No Disponibles para las operaciones realizadas con recursos asignados a la salud, es el siguiente:

ARTÍCULO 7o. PRECIO POR UNIDAD DE REGULACIÓN DE MEDICAMENTOS VITALES NO DISPONIBLES REGULADOS EN ANTERIORES CIRCULARES DE LA COMISIÓN. <Circular derogada por la Circular 19 de 2024> El Precio Máximo de Venta por unidad de regulación de los medicamentos definidos como Vitales No Disponibles, cuyo precio no fue actualizado mediante un nuevo ejercicio de referenciación en la presente circular, será el siguiente:
ARTÍCULO 8o. MONITOREO DEL COMPORTAMIENTO DE LOS PRECIOS DE LOS MEDICAMENTOS EN LAS TRANSACCIONES INSTITUCIONALES. <Circular derogada por la Circular 19 de 2024> Los Mercados Relevantes listados a continuación estarán sujetos a monitoreo por parte de la CNPMDM considerando la diferencia entre el Precio de Referencia Internacional (PRI) y el Precio de Referencia Nacional -PRN, así como el comportamiento estable de los precios en el mercado farmacéutico.
<Consultar tabla directamente en el siguiente enlace:
http://168.61.69.177/documentospdf/PDF/C_CNPMD_0013_2022-ANEXO.pdf
PARÁGRAFO. En caso de evidenciar incrementos injustificados en los precios por encima de la variación del IPC transcurrido desde el periodo de referencia de la presente circular hasta el inicio del periodo de análisis, la Comisión podrá fijar como Precio Máximo de Venta, una fracción del PRI, la cual será equivalente al Precio de Referencia Nacional - PRN, de acuerdo con lo dispuesto en el numeral b) literal ii del artículo 19 de la Circular 03 de 2013.
ARTÍCULO 9o. MARGEN ADICIONAL PARA LAS INSTITUCIONES PRESTADORAS DE SERVICIOS DE SALUD (IPS). <Circular derogada por la Circular 19 de 2024> Las instituciones prestadoras de servicios de salud podrán ajustar el precio regulado en los artículos 3o, 4o, 5o, 6o, 7o y 8o de la presente Circular, de la siguiente manera:
7.1. Para las presentaciones comerciales con Precio Máximo de Venta menor o igual a $1.000.000, podrán adicionar un porcentaje de hasta el 7%.
7.2. Para las presentaciones comerciales con Precio Máximo de Venta mayor a $1.000.000, podrán adicionar un porcentaje de hasta el 3.5%.
Este margen es exclusivamente para reconocer el valor que las IPS agregan a la cadena de distribución de los medicamentos.
PARÁGRAFO. La Comisión observará el comportamiento de los precios de los medicamentos regulados y adoptará, en el marco de sus competencias, las medidas que sean del caso, con el fin de asegurar que, de adicionarse dicho margen al precio, se haga exclusivamente por parte de las IPS.
ARTÍCULO 10. DESCRIPCIÓN DEL PRINCIPIO ACTIVO DE LOS MERCADOS RELEVANTES. <Circular derogada por la Circular 19 de 2024> En los casos en los que el principio activo regulado se encuentre registrado ante el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) con código ATC que no coincida con el asignado por el Grupo de Investigación del Uso de Fármacos, en inglés, la Drug Utilization Research Group, de la Organización Mundial de la Salud (OMS), para efectos regulatorios se tomará en cuenta la descripción del principio activo incluida en el registro sanitario.
ARTÍCULO 11. REGULACIÓN DE FORMAS FARMACÉUTICAS. <Circular derogada por la Circular 19 de 2024> Si la descripción de la forma farmacéutica de un mercado relevante es “sólido - oral” y no existe un mercado relevante adicional con el mismo principio activo y una forma farmacéutica “sólido - oral de liberación modificada”, se entenderá que el precio para el Mercado Relevante con forma farmacéutica “sólido - oral” aplicará para todas las presentaciones con esta última forma farmacéutica, independientemente de que modifique o no la liberación del fármaco.
ARTÍCULO 12. PROHIBICIÓN DE INCREMENTAR EL PRECIO MÁXIMO DE VENTA POR INTERMEDIACIÓN. <Circular derogada por la Circular 19 de 2024> El Precio Máximo de Venta de los medicamentos listados en los artículos 3 y 5 de la presente Circular, serán el máximo permitido para realizar operaciones en la cadena de comercialización y ningún actor de la cadena que realice operaciones en las transacciones institucionales y comerciales definidas en el artículo 2o de la Circular 06 de 2018, podrán sobrepasar el precio regulado.
PARÁGRAFO. Lo dispuesto en el presente artículo no aplicará en las transacciones comerciales establecidas en el artículo 20 de la Circular 03 de 2013. Sin perjuicio de la libertad de precios para farmacias-droguerías y droguerías, la Comisión observará el comportamiento de los precios con el fin de garantizar que las reducciones se trasladen al consumidor final.
ARTÍCULO 13. SANCIONES POR INCUMPLIMIENTO AL RÉGIMEN DE CONTROL DE PRECIOS. <Circular derogada por la Circular 19 de 2024> La Superintendencia de Industria y Comercio - SIC, en virtud de lo dispuesto en el artículo 132 de la Ley 1438 de 2011, sancionará las infracciones al régimen de control de precios de medicamentos establecidos en la presente Circular.
ARTÍCULO 14. VIGENCIA Y DEROGATORIA. La presente Circular rige a partir de su publicación en el Diario Oficial, surte efectos a los dos (2) meses siguientes a dicha publicación y deroga la Circular 12 de 2021, a partir de esta última fecha.
Publíquese y cúmplase.
Dada en Bogotá, D. C., a 25 de julio de 2022.
El Ministro de Salud y Protección Social,
Fernando Ruiz Gómez
La Ministra de Comercio, Industria y Turismo,
María Ximena Lombana Villalba.
La Delegada del Presidente de la República,
Clara Elena Parra Beltrán
Las notas de vigencia, concordancias, notas del editor, forma de presentación y disposición de la compilación están protegidas por las normas sobre derecho de autor. En relación con estos valores jurídicos agregados, se encuentra prohibido por la normativa vigente su aprovechamiento en publicaciones similares y con fines comerciales, incluidas -pero no únicamente- la copia, adaptación, transformación, reproducción, utilización y divulgación masiva, así como todo otro uso prohibido expresamente por la normativa sobre derechos de autor, que sea contrario a la normativa sobre promoción de la competencia o que requiera autorización expresa y escrita de los autores y/o de los titulares de los derechos de autor. En caso de duda o solicitud de autorización puede comunicarse al teléfono 617-0729 en Bogotá, extensión 101. El ingreso a la página supone la aceptación sobre las normas de uso de la información aquí contenida.